Acide carbonique
L’acide carbonique est un composé chimique de formule H2CO3. Il s'agit d'un acide faible dont les bases conjuguées sont les anions HCO3− (bicarbonate) et CO32− (carbonate).
Ne doit pas être confondu avec Acide carbolique.
| Acide carbonique | |
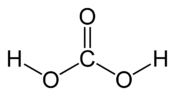 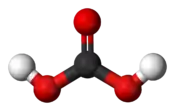 Structure de l'acide carbonique. |
|
| Identification | |
|---|---|
| Nom UICPA | acide carbonique carbonate d'hydrogène |
| No CAS | |
| No ECHA | 100.133.015 |
| No CE | 610-295-3 |
| PubChem | 767 |
| ChEBI | 28976 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | H2CO3 |
| Masse molaire[1] | 62,024 8 ± 0,001 8 g/mol C 19,36 %, H 3,25 %, O 77,39 %, |
| pKa | 6,37 et 10,32 (diacide) |
| Propriétés physiques | |
| Solubilité | Sol. dans l'eau |
| Cristallographie | |
| Classe cristalline ou groupe d’espace | P213[2] |
| Paramètres de maille | a = b = c = 8,600 Å α = β = γ = 90,00° |
| Volume | 636,06 Å3[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Acidité
L'acide carbonique se forme en particulier dans l'eau par solvatation du dioxyde de carbone[3] :
avec une constante d'équilibre d'hydratation valant Kh = [H2CO3] / [CO2] ≈ 1,70 × 10−3 à 25 °C.
En solution aqueuse, l'acide carbonique est un diacide, c'est-à-dire qu'il peut se dissocier deux fois en libérant chaque fois un proton :
Quand l'acide carbonique est combiné avec un cation, des sels nommés « bicarbonates » et « carbonates » peuvent se former. Par exemple, combiné avec de la chaux (hydroxyde de calcium), il constitue du carbonate de calcium (constituant principal du calcaire, de la craie).
Rôle
Naturels
L'augmentation de la quantité de CO2 dans l'atmosphère entraine une acidification des océans[4] :
- CO2 + H2O → H2CO3
L'acide carbonique est formé par hydratation du CO2 dissout dans les océans.
Chez l'Homme, il est produit dans le sang grâce au CO2 issu de la chaine respiratoire mitochondriale. Ce CO2 peut produire de l'acide carbonique décrit pour tamponer le sang, ou être directement éliminé par les poumons au cours de l'hématose.
Industrie alimentaire
L'acide carbonique est présent dans les boissons gazeuses. Dans l’eau, le CO2 forme l’acide carbonique, qui picote la langue, renforce le goût et agit comme un bactéricide doux. Il active le passage des aliments de l’estomac vers l’intestin.[réf. nécessaire]
Il a été utilisé pour la conservation de la viande.
Dérivés
L'acide carbonique compte de nombreux dérivés, exemples :
- acides carbamiques ;
- carbamides ou urées ;
- carbamates ou uréthanes ;
- phosgène.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Carbonic acid », sur www.reciprocalnet.org (consulté le ).
- « La chimie du carbone inorganique dans l'eau et le captage du CO2 », sur www2.ggl.ulaval.ca (consulté le ).
- « Acide carbonique : qu'est-ce que c'est ? », sur Futura (consulté le ).