Sumac grimpant
Toxicodendron radicans
Pour les articles homonymes, voir Poison Ivy.

| Règne | Plantae |
|---|---|
| Sous-règne | Tracheobionta |
| Division | Magnoliophyta |
| Classe | Magnoliopsida |
| Sous-classe | Rosidae |
| Ordre | Sapindales |
| Famille | Anacardiaceae |
| Genre | Toxicodendron |
| Ordre | Sapindales |
|---|---|
| Famille | Anacardiaceae |
Le sumac grimpant, herbe à puce, bois de chien, sumac vénéneux ou poison ivy (Toxicodendron radicans, anciennement Rhus radicans) est une liane de la famille des Anacardiaceae, comme les anacardiers et les pistachiers. C'est une plante sauvage originaire d'Amérique du Nord, où elle est commune dans une grande partie des États-Unis et du Canada. Il est aussi possible de la voir en Amérique du Sud et en Asie tempérée. Comme celle d'autres espèces proches, sa sève peut être sensibilisante et induire de sévères réactions allergiques (dermatite de contact).
Synonymes
- Rhus radicans L.
- Rhus toxicodendron sensu P.Fourn. (ne pas confondre avec Rhus toxicodendron L. qui est, en fait, Toxicodendron pubescens Mill.)
Description
- Cette plante adopte divers ports : rampante, dressée et buissonnante, ou longuement grimpante.
- Les feuilles sont pétiolées, trifoliolées, à folioles ovées ou rhomboïdales, entières ou crénelées ou irrégulièrement paucidentées.
- Les fleurs (longueur 3 mm) sont verdâtres, en panicule axillaire lâche
- Le fruit est glabre, blanc.
 « Tronc » d'une liane ancienne.
« Tronc » d'une liane ancienne. Feuillage d'automne.
Feuillage d'automne. Jeunes feuilles.
Jeunes feuilles. Floraison.
Floraison. Fruits immatures (fin d'été).
Fruits immatures (fin d'été).
Reproduction
Cette espèce se multiplie par ses graines. Toutefois, les individus sont souvent sans fleurs et sans fruits. Lorsqu'elle a lieu, sa floraison est estivale[1].
Écologie

La sève de cette espèce est très irritante et allergène pour l'Homme, mais les oiseaux mangent ses fruits sans problèmes, et divers herbivores (bétail y compris) broutent ses feuilles apparemment sans effets nocifs pour eux[1].
Les oiseaux frugivores sont considérés comme les disperseurs des graines de cette espèce[2]. Or ces oiseaux, comme d'autres, voient leur aire de répartition rapidement changer[3], de même pour leurs dates de migration[4] en raison des changements climatiques (qui perturbent la phénologie des espèces, en ville notamment[5] surtout pour les oiseaux effectuant de longues migrations[4]), et des modifications écopaysagères induites par les activités humaines (agriculture, foresterie, urbanisme, voies de circulation, éclairage nocturne…).
Des scientifiques cherchent à modéliser les effets des grandes perturbations humaines (artificialisation, destruction et fragmentation des habitats naturels, urbanisation, pollution, changement climatique, etc.) sur les écosystèmes en général, et sur les espèces susceptibles de poser problèmes pour la santé et/ou de devenir invasives en particulier. Le sumac grimpant, originellement principalement associé à certains biomes et habitats forestiers fait partie des espèces susceptibles d'être perturbées par des changements de niche écologique[6]. De plus, les incendies de forêt (de plus en plus graves ou plus fréquents) peuvent disperser les allergènes synthétisés par cette liane.
À ce jour, selon Istvan Karsai et al. (2022), en modélisant les effets croisés de l'urbanisation et du changement climatique sur la maturation et dispersion des graines de sumac par les oiseaux (en tenant compte des pertes par chutes au sol, fruits parasités ou consommés par les oiseaux), le succès de germination devrait plutôt diminuer en zone urbaine (bien que les sumac y produisent généralement plus de fruits qu'ailleurs). Selon les scénarios climatiques, l'« inadéquation phénologique » (Asynchronisme entre les rythmes biologique des plantes et des oiseaux disperseurs de graines)[7] pourraient, plus ou moins, s'aggraver[8], au détriment des succès de germination du sumac), et c'est en ville qu'on s'attend aux effets les plus exacerbés du réchauffement global (avec des effets synergiques). En 2022 on manque encore de donnée pour bien prédire et atténuer les effets de l'anthropisation sur les Sumacs[2].
Le sumac : favorisé par le réchauffement climatique et par l'augmentation du taux de dioxyde de carbone
Le dioxyde de carbone, en forte augmentation dans la biosphère, est au cœur du métabolisme végétal. Selon Zhu et al. (2016) l'indice de surface foliaire intégré à la saison de croissance a augmenté sur 25 à 50 % de la surface végétale mondiale au cours de la période 1982 à 2009, alors qu'elle n'a diminué que sur 4 % du globe. Cette croissance accélérée des végétaux est due à une « eutrophisation/fertilisation » de la biosphère par le dioxyde de carbone (expliquant 70 % de cette tendance), et secondairement aux dépôts accrus d'azote (9 %), au changement climatique (8 %) et au changement d'occupation du sol (4 %)[9].
Dans le même temps, on observe un déclin spectaculaires des populations d'arthropodes (insectes notamment). Une hypothèse explorée est que cet effondrement pourrait être en partie dû aux températures moyennes plus élevées[10] et à l'enrichissement de l'air en dioxyde de carbone (+ 33 % environ entre les années 1950 et 2020, avec un passage de 300 ppm à plus de 400 ppm de dioxyde de carbone dans l'atmosphère) ;
ces deux phénomènes respectivement dopent la croissance des plantes, et les rendent moins sujettes à l'herbivorie des insectes, avec notamment deux conséquences possibles :
- croissance du rapport carbone/azote des tissus végétaux : elle suit celle du taux de dioxyde de carbone dans l'air, ce qui induirait une chute des taux d'azote rendant les plantes (et leur pollen) moins riches en protéiques et moins nutritives[11],[12],[13],[14] ;
- augmentation des insecticides biosynthétisés par les plantes pour se défendre : à titre d'exemple, Mohan et al. ont suggéré en 2006 que ces deux phénomènes peuvent expliquer la croissance de la biomasse du Sumac Toxicodendron radicans ; selon eux, les plantes qui profitent d'une teneur élevée de l'air en dioxyde de carbone synthétisent en plus grande quantité une forme toxique du composé allergène urushiol[15].
Selon Landosky et Karowe (2014) les herbivores spécialisés peinent à faire face à des défenses chimiques plus efficaces chez les plantes qu'ils consomment[16]. Hall et al. en 2005 observent que la croissance du taux de dioxyde de carbone s'accompagne de moindres dommages causés aux plantes par quatre des six groupes d'insectes phytophages étudiés[11]. Selon Agrawal (2017), chez diverses espèces et variétés d'asclépiade, la synthèse de composés dissuasifs (cardénolides) est inversement corrélée au taux de croissance de ces plantes, laissant penser que produire des composés insecticides est énergétiquement coûteux pour ces plantes[17] ; les facteurs dopant la croissance des plantes pourraient donc aussi favoriser une production accrue de ces bioinsecticides. On a montré en 2005 que les taux de tanins condensés augmentent dans la litière de feuilles de chêne en condition de dioxyde de carbone élevé. Les composés insecticides produit par l'arbre pourrait donc aussi affecter les insectes et autres invertébrés (détritivores) se nourrissant des feuilles et bois morts.
50 % de toutes les espèces d'insectes sont herbivores[17], les défenses des plantes impliquent la production de composés insecticides à base de carbone et d'azote. Mais si les défenses « à base de carbone » peuvent croître quand l'air s'enrichit en dioxyde de carbone, celles à base d'azote peuvent décroître, car comme rappelé par Bartlett en 2019. Le dioxyde de carbone élevé tend à faire croître le rapport carbone/azote dans les tissus végétaux[18]. Certains insectes sont déjà capables de riposter à une défense accrue chez les plantes en contexte de dioxyde de carbone élevé ; ainsi les pucerons disposent de gènes les rendant résistants aux défenses des plantes. De même, les mangeurs de phloème réagissent mieux que d'autres insectes qui mangent directement les tissus foliaires[13],[18]. Les populations de papillons (lépidoptères) se sont effondrées, semble-t-il en partie à cause du taux de dioxyde de carbone de l'air, mais selon Robinson et al. (2012), deux groupes d'arthropodes (homoptères et acariens semblent au contraire en bénéficier)[19].
Les effets du facteur dioxyde de carbone peuvent être exacerbés ou inhibés par d'autres conséquence de l'anthropisation du monde et des modifications climatiques, dont l'hygrométrie, la pluviométrie, la disponibilité de l'eau du sol, la température, le vent, de nouvelles phytopathologies, etc.[20].
Histoire, usages médicinaux anciens
C'est au feu maréchal de Croy que la ville de Valenciennes et moi furent redevables du Rhus-radicans ou Toxicodendron.
Selon le médecin valenciennois André Ignace Joseph Dufresnoy :
« cette plante avoit toujours passé pour inutile et même dangereuse en médecine. Un jeune fleuriste étant venu dans le jardin botanique de Valenciennes, un jour de leçon publique, pour y voir des plantes exotiques et étrangères que j'avois récemment reçues de Hollande ; il me fit, après la leçon, plusieurs questions sur le Rhus radicans dont je venois de faire la démonstration. Je n'avois pas omis, dans ma démonstration, de parler des précautions à prendre même pour cueillir cette plante et se préserver de ses effets nuisibles : mais un élève très-instruit et qui broýe impunément cette même plante avec ses mains, n'eut pas de peine à persuader au jeune Fleuriste, que le Rhus radicans n'avoit point en France les mauvaises qualités que je venois de lui attribuer. Pour prouver son assertion, il en prit une poignée de feuilles, les brisa, s'en frotta même les mains et les poiguets, comme il avoit déjà fait plusieurs fois, sans en ressentir la plus légère incommodité.
Le Fleuriste , convaincu que j'avois, voulu l'amuser, renchérit sur mon élève, en affectant de broyer cette plante plus long-temps dans ses mains, et ne tarda point à se repentir de son imprudence. Le lendemain il se plaignit d'une démangeaison incommode aux mains et aux poignets. Mon élève, qu'il consulta, prit cette démangeaison pour l'indice de la galle, qu'il avoit, lui dit-il, sans doute prise dans le voyage qu'il venoit de faire. Il lui conseilla, pour arrêter les progrès de cette maladie, de se frotter, le même jour, les mains et les poignets, avec une demionce d'onguent citrin, et de se purger le lendemain avec des pilules mercurielles. Ces conseils, furent suivis ; mais le jour de la purgation, les démangeaisons augmentèrent, et les poignets ainsi que les mains, commencèrent à gonfler et se couvrir d'un grand nombre de petits boutons, qui lui firent croire que c'étoit réellement la galle. L'élève, consulté de nouveau, s'applaudit d'avoir bien deviné, lui fit frotter les mêmes parties, comme étant le siége de la maladie, avec le double d'onguent, afin d'aller plus vîte. Le lendemain de la deuxième friction, les mains et les poignets, dont le gonflement avoit augmenté pendant la nuit, étoient couverts d'une grande quantité de petits vésicules, qui se remplirent, en grossissant de plus en plus pendant sept ou huit jours, d'une sérosité jaunâtre qui annonçoit un érésipèle fâcheux. Malgré les saignées, les bains, les fomentations émollientes et les boissons délayantes, la tête s'enfla si fort qu'il fut aveugle, par le gonflement prodigieux des paupières, pendant plus de vingt-quatre heures. Les démangeaisons se portèrent ensuite sur toutes les parties du corps, principalement les chevelues et celles de la génération, qu'il se mit en pièces à force de se gratter.
Au bout de dix jours les accidens cessèrent ; les poignets, qui avoient jeté beaucoup de sérosités, se dépouillèrent de leur épiderme , et le malade fut fort étonné de se voir guéri d'une dartre qu'il portoit à l'un de ses poignets depuis plus de six ans. Cette dartre avoit éludé les frictions, le sublimé corrosif à la plus forte dosé, ête les remèdes prescrits par les personnes de l'art, les plus éclairées de la province : depuis elle n'a plus reparu.
Persuadé que le jeune homme dont je viens de parler, ne devoit point sa guérison à longuent citrin, comme il le croyoit, mais qu'il en étoit redevable au Rhus-radicans, j'ai cru pouvoir l'employer intérieurement, sur plusieurs personnes attaquées de différentes espèces de dartres. J'ai commencé par faire sur moi-même l'essai de l'infusion de cette plante. Je n'avois point de dartres ; mais je voulus m'assurer des effets qu'elle pouvoit produire sur l'estomac. Je fis donc infuser une foliole fraîche dans une livre d'eau bouillante, et je commençai par en prendre, soir et matin, une cuillerée à bouche. Cette dose ne me produisant pas d'effets sensibles, j'augmentai le nombre des folioles jusqu'à douze, pour la même quantité d'eau. J'observai qu'à cette dose mon estomac me faisoit un peu de mal, que ma transpiration et mes urines étoient plus abondantes.
Convaincu, par ma propre expérience, que l'infusion du Rhus-radicans, prise intérieurement, ne pouvoit produire aucun effet dangereux, je n'hésitai point à l'employer contre les affections dartreuses. Non-seulement ce remède me réussit ; mais on verra par les observations que je vais rapporter, que les succès que j'obtins contre ce genre de maladie, me conduisirent à la découverte de ses effets salutaires contre la paralysie des extrémités inférieures, ou la paraplexie »
— André Ignace Joseph Dufresnoy (1799), Des caractères de traitement et de la cure des dartres
Dufresnoy explique qu'il avait d'abord souhaité vérifier l'efficacité de la plante sur une vingtaine de malades avant de publier ces résultats, mais il les a publié plus tôt (dès 1788) car un article était en préparation à Paris présentait la plante comme très dangereuse, ce qui risquerait de priver certains malades de son effet bénéfique à leur égard.
Dufresnoy ajoute qu'après cette première publication, « des médecins qui, non-seulement n'avoient jamais employé cette plante, mais qui vraisemblablement n'en avoient jamais entendu parler, ou qui ne la connoissoient que de nom, avant que j'en eusse annoncé les vertus, se déchaînèrent avec aussi peu de raison que ceux qui se récrièrent pendant si long-temps contre la Cigue, et sur le danger de l'employer en médecine »[21].
Dufresnoy affirmera plus tard que avoir toujours utilisé avec succès les extraits de Rhus radicans[22] plante contre les dartres et contre certaines paralysies. Il a utilisé l'eau distillée des feuilles du Rhus radicans, parfois « dans une légère infusion de feuilles de laurier-cerise » ou mêlée le matin avec du lait, et le soir avec un peu d'eau sucrée.
Dufresnoy utilisait une infusion de feuilles fraîches ou séchées (remplacée durant l'hiver par l'infusion de tiges du Sumac Rhus-radicans). Selon Dufresnoy (1799), ce médicament se montrait également efficace contre certaines formes de paralysie[21].
Il évoque aussi un possible effet antidépresseur ou euphorisant :
« La malade ne s'est aperçu de rien depuis la guérison. Elle m'a dit, qu'étant d'un caractère enclin à la tristesse, elle se trouvoit gaie et toujours mieux disposée au travail, aussitôt qu'elle avoit avalé son infusion de Rhus radicans Les autres malades, qui en ont fait usage depuis, m'ont fait le même aveu »
— André Ignace Joseph Dufresnoy (1799), Des caractères de traitement et de la cure des dartres
Sève allergène
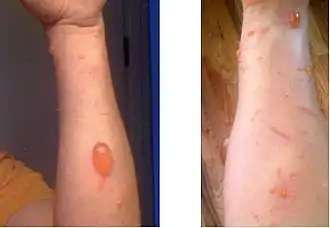
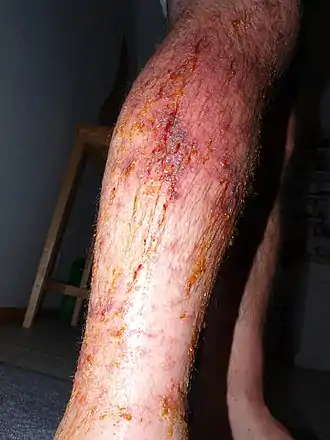
Le fauchage ou l'utilisation d'un rotofil jambes nues et sans vêtement de protection est à proscrire.


_(8729643517).jpg.webp)
Symptômes
Le contact direct avec la sève de Toxicodendron radicans ou tout contact indirect avec des vêtement (ex. : une simple étiquette de vêtement d'origine indienne, ayant reçu de la résine de Semecarpus anacardium[23]), des outils, des animaux présentant des traces d'urushiol suffit à déclencher une allergie cutanée.
Dès le premier contact avec l'urushiol du sumac grimpant (sensibilisation), il est possible de développer une dermatite de contact. La fumée issue d'un feu de forêt ou plus encore issue du brûlage direct de la plante, ou de déchets de tonte, de fauchage ou débroussaillage mécaniques contenant la plante peuvent libérer l'oléorésine dans l'air et provoquer une réaction allergique[24]. Les feuilles mortes de la plante, même après quelques années (5 ans) peuvent provoquer une réaction allergique chez les plus sensibles[réf. souhaitée].
Une première exposition entraîne généralement un prurit et un érythème, suivis d'une éruption papulovésiculaire, d'un œdème et d'un suintement dans les 10 à 14 jours[25]. En cas de réexposition, les symptômes seront plus aigus et apparaissent en 24 à 72 heures[25]. Des taches noires sont parfois présentes sur la peau ou sur les vêtements (urushiol oxydé à la suite de son exposition à l'air)[26],[27],[28],[29]. Vues au dermoscope, ces taches apparaissent comme des lésions de couleur brun foncé, bordées de rouge[28].
Au premier contact, des cellules T sont activées, ce qui entraîne la production de cellules T CD4 et CD8 sensibles à l'urushiol. Ces dernières vont activer une réponse immunitaire plus vive et robuste lors des prochaines expositions à l'urushiol. Les kératinocytes et les monocytes semblent également jouer un rôle dans la libération de cytokines locales et de médiateurs pro-inflammatoires[30],[31]. Beaucoup de ces voies peuvent être bloquées ou inhibées par un traitement corticoïde[25].
Épidémiologie
Le contact avec le suc de cette plante est l'une des causes les plus fréquentes de dermatite de contact (dermatose bulleuse dans les cas les plus sévères) aux États-Unis[32] et la cause la plus fréquente est le contact avec le suc de cette espèce et de 3 autres espèce proches[33].
Cette dermatite peut survenir à tout âge, dans toutes les ethnies et sur tout type de peau ; environ 25 à 40 millions de cas étaient traités par an dans les années 1980[34],[35]. Les travailleurs exposés (services forestiers notamment) sont couramment touchés, aux extrémités le plus souvent[35],[36],[37].
Mécanisme allergique
Quand la sève ou le suc du sumac entre en contact avec la peau humaine, elle provoque une réaction allergique extrêmement irritante (impliquant une libération de cytokines locales via des cellules présentatrices d'antigène (APC), et d'autres médiateurs inflammatoires aigus qui initient la sensibilisation, via les mastocytes)[38],[25], avec dans les cas graves des lésions bulleuses pouvant se surinfecter.
Le composé allergène du suc est rapidement absorbé dans la peau car très lipophile. Il est capté par les cellules de Langerhans de l'épiderme (ce pourquoi le lavage doit être fait rapidement)[39]. La dermatite de contact apparaît généralement 24 à 48 heures après le contact, et parfois jusqu'à 2 semaines plus tard.
Les symptômes disparaissent au mieux dans les 2 à 5 jours et après quelques semaines dans les cas sévères non soignés. Il est fréquemment indiqué que le premier contact ne provoque pas d'effet autre que de sensibiliser l'individu chez lequel un contact ultérieur provoquera la réaction allergique[réf. souhaitée].
L'agent irritant est un « phénol dihydrique » du groupe des urushiols, appartenant à la famille des « lipides phénoliques non isoprénoïdes », qui sont des lipides contenant des phénols monohydriques, biosynthétisés par la voie des polykétides[40]. Ils sont produits par certaines plantes, mais aussi par des insectes (d'autres composés de ce groupe sont les cardols, les alc(én)ylrésorcinols, et les acides phénoliques dont par exemple les acides anacardiques[40].
Ces composés ont des propriétés biologiques particulière[40] ; l'urushiol est très tenace et non volatil, il peut occasionner des lésions par contact direct ou indirect avec des feuilles, tiges ou racines coupées, meurtrie ou blessées de la plante.
Des expériences faites sur le modèle animal murin[41] (application sur la peau des composants de l'huile d'urushiol de sumac vénéneux, espèce proche du Sumac grimpant) ont montré que la souris est sensible au suc de la plante durant environ 25 jours. l'analyse de sérums prélevés quand la réponse de sensibilisation de contact diminuait chez ces animaux, a montré que l'allergie disparaissait quand l'induction de la sensibilisation au 3-n-pentadécylcatéchol(PDC), un composant de l'urushiol diminuait ; le facteur sérique suppressif est un composé spécifique, présent en plus grande quantité 25 jours après la sensibilisation, mais qui n'est plus détectable 40 jours après la sensibilisation. Il s'est montré transférable à une autre souris pour prévenir l'allergie (désensibilisation) : une seule dose de 0,6 ml de la fraction IgG purifiée administrée 7 jours avant la sensibilisation d'une souris suffit.
Une autre étude a montré que les fractions d'immunoglobulines IgG sériques de sujets humains hyposensibilisés au sumac vénéneux (par administration orale d'urushiol) suppriment l'induction de réponses d'hypersensibilité de type retardé (DTH) chez la souris à cet haptène[42].
Degré de susceptibilité individuelle
En Amérique du Nord, environ 50 à 70 voire 75 % de la population serait sensible au suc de cette plante[43]. Des causes génétiques ou d'histoire de vie peuvent expliquer ces variations de susceptibilité selon l'individu ou le moment de la vie.
En particulier, beaucoup d'allergènes et de sensibilisants cutanés connus (ou leurs variantes chimiques) sont ingérés via l'alimentation ou d'autres sources[44]. Or l'exposition orale à des substances antigéniques peut entraîner une tolérance[45] ; ce qui explique que la consommation/ingestion de sensibilisants peut avoir un impact sur le degré (étendue, durée et force) de la sensibilisation cutanée, surtout si le sensibilisant a été consommé tôt dans la vie, avant le premier contact avec la peau[44]. Une revue récente (2020) de la littérature clinique et épidémiologique humaine a porté sur ce sujet[44].
Possibles allergies croisées
Chez les patients sensibilisés à l'urushiol, un risque d'allergie croisée est possibles avec la sève ou les produit (fruits ; mangue, noix de cajou…) de plusieurs autres espèces de la famille des noix de cajou/sumac ou Anacardiaceae ; de même avec le ginkgo biloba[2].
Prise en charge
Immédiatement, si possible, laver à l'eau froide et au savon (ou avec un détergent doux) les parties du corps ayant été en contact avec le suc[39], c'est la méthode la plus raisonnable (par rapport à d'autres plus coûteuse et/ou difficilement applicable rapidement car moins rapidement accessibles pour le patient). Il est cependant important de penser à nettoyer sous les ongles et de conserver à l'esprit que les cheveux, la barbe, moustache doivent aussi être lavés si l'on pense qu'ils ont été directement ou indirectement exposés au suc de la plante[46].
On lit parfois qu'il est préférable de ne pas utiliser de savon car il contribuerait à étaler la sève toxique et/ou enlever la couche lipidique qui protège naturellement la peau ; le lavage au savon n'annulant pas complètement l'effet, mais pouvant le diminuer[47]. Il y a consensus sur le fait que les vêtements éventuellement contaminés par le suc de la plante doivent être retirés dès que possible et soigneusement lavés. Les outils contaminés sont aussi une source possible d'allergène.
Par la suite, la calamine et les pansements humides peuvent soulager les démangeaisons.
Les antihistaminiques (topiques ou oraux) ont un effet provisoirement sédatif contre le prurit, mais ne guérissent pas la lésion, car le processus biochimique en cause n'est pas dû à une libération d'histamine[25].
Des corticostéroïdes, administré sous forme de médicament topiques ou sous forme systémiques (à dose modérée à élevée)[48] sont utiles au début de l'évolution des lésions, surtout si appliqués avant l'apparition de papules ou de vésicules[49],[50].
Dans les cas sévères, une prescription de prednisone est utile, mais à dose décroissante en commençant par 1 mg/kg/jour chez l'adulte moyen (0,5 mg/kg/jour chez les enfants) pour une dose maximale de 60 mg/jour et diminuer chaque semaine pendant trois semaines pour prévenir la dermatite de rebond[51],[52].
Les alternatives pour les patients qui pourraient ne pas supporter les corticostéroïdes systémiques sont l'application de corticostéroïdes topiques (à dose modérée) avec un pansement occlusif pendant 24 heures, ensuite renouvelé 48 heures après l'application initiale[53].
Une crème à base de cortisone aide à assécher les lésions bulleuses.
Le Buro (topique à base d'acétate d'aluminium vendu en pharmacies) soulagera l'inflammation de la peau. Après application du Buro-Sol, une crème d'hydro-cortisone peut être appliquée sur la peau sèche[réf. souhaitée].
Prévention
Les personnes travaillant ou se rendant dans des environnement riche en sumac devraient apprendre à identifier la plante et à s'en protéger et disposer de quoi se soigner rapidement en cas de contact avec le suc de la plante. Différents barrières de protection topiques (crèmes, nomades) ont été testées, dont l'une à base d'argile absorbante (bentonite)[54],[55].
Biochimie
Dans la seconde partie du XXe siècle, des méthodes ont été développée pour améliorer l'analyse et l'étude des fractions d'urushiol d'extraits de différentes parties de plantes, pour améliorer notamment l'analyse GLC directe des congénères catéchol C15 alcényle de la chaîne latérale contenus dans la fraction urushiol d'autres plantes et des homologues C17 du sumac vénéneux ; plusieurs phases liquides en ont été étudiées, à divers degrés de séparation[56]. « Les effets de l'extraction avant et après séchage ont démontré qu'un plus grand pourcentage d'urushiol était obtenu lorsque le matériel végétal frais était extrait avec de l'éthanol »[56].
Aspects éco-génomiques
En 2015, des chercheurs ont séquencé et publié le génome entier de cette plante. Ils ont également annoté 11 bactéries endophytes (endobactéries) des tissus de Toxicodendron radicans, dont cinq appartiennent au genre Pseudomonas et six sont des membres uniques d'autres genres[57]. Ce génome comprend 454 874 194 paires de bases, réparties en 42 021 gènes[58].
Selon les auteurs[57], il serait intéressant d'étudier l'éventuelle capacité de ces souches bactériennes à métaboliser l'huile d'urushiol car l'importance du groupe des Pseudomonas endophytes isolées par cette étude (comme c'est aussi le cas pour d'autres plantes, dont notamment la vigne[59], y compris dans ses fleurs[60] ou encore dans les graines d'épinette de Norvège (11) peut faire évoquer une relation symbiotique mutualiste avec la plantes (ces bactéries favorisent sa croissance de la plante qui en échange leur offre un habitat et des sucre via la photosynthèse[61].
Notes et références
- « Herbe à puce », sur espacepourlavie.ca.
- (en) Istvan Karsai, Amber Stanley et Gerardo Arceo Gomez, « Population models reveal synergistic fitness effects of climate change and urbanization on poison ivy (Toxicodendron radicans) via disruption of seed dispersal interactions », Urban Ecosystems, (ISSN 1083-8155 et 1573-1642, DOI 10.1007/s11252-022-01243-6, lire en ligne, consulté le ).
- (en) C. Wilsey, B. Bateman, L. Taylor, J. X. Wu, G. LeBaron, R. Shepherd, C. Koseff, S. Friedman et R. Stone, Survival by Degrees : 389 Bird Species on the Brink (rapport), New York, Société nationale Audubon, , 68 p. (lire en ligne [PDF]).
- (en) Christiaan Both, Chris A. M. Van Turnhout, Rob G. Bijlsma et Henk Siepel, « Avian population consequences of climate change are most severe for long-distance migrants in seasonal habitats », Proceedings of the Royal Society B: Biological Sciences, vol. 277, no 1685, , p. 1259–1266 (ISSN 0962-8452 et 1471-2954, PMID 20018784, PMCID PMC2842804, DOI 10.1098/rspb.2009.1525, lire en ligne, consulté le )
- (en) Marina Alberti, Cristian Correa, John M. Marzluff et Andrew P. Hendry, « Global urban signatures of phenotypic change in animal and plant populations », Proceedings of the National Academy of Sciences, vol. 114, no 34, , p. 8951–8956 (ISSN 0027-8424 et 1091-6490, PMID 28049817, PMCID PMC5576774, DOI 10.1073/pnas.1606034114, lire en ligne, consulté le )
- (en) John A. Wiens, Diana Stralberg, Dennis Jongsomjit et Christine A. Howell, « Niches, models, and climate change: Assessing the assumptions and uncertainties », Proceedings of the National Academy of Sciences, vol. 106, no supplement_2, , p. 19729–19736 (ISSN 0027-8424 et 1091-6490, PMID 19822750, PMCID PMC2780938, DOI 10.1073/pnas.0901639106, lire en ligne, consulté le )
- (en) Juan P. González‐Varo, Juan M. Arroyo et Pedro Jordano, « The timing of frugivore‐mediated seed dispersal effectiveness », Molecular Ecology, vol. 28, no 2, , p. 219–231 (ISSN 0962-1083 et 1365-294X, PMID 30151871, PMCID PMC6905405, DOI 10.1111/mec.14850, lire en ligne, consulté le )
- (en) Louie H. Yang et V. H. W. Rudolf, « Phenology, ontogeny and the effects of climate change on the timing of species interactions », Ecology Letters, vol. 13, no 1, , p. 1–10 (DOI 10.1111/j.1461-0248.2009.01402.x, lire en ligne, consulté le )
- (en) Zaichun Zhu, Shilong Piao, Ranga B. Myneni et Mengtian Huang, « Greening of the Earth and its drivers », Nature Climate Change, vol. 6, no 8, , p. 791–795 (ISSN 1758-678X et 1758-6798, DOI 10.1038/nclimate3004, lire en ligne, consulté le ).
- (en) Bradford C. Lister et Andres Garcia, « Climate-driven declines in arthropod abundance restructure a rainforest food web », Proceedings of the National Academy of Sciences, vol. 115, no 44, (ISSN 0027-8424 et 1091-6490, DOI 10.1073/pnas.1722477115, lire en ligne, consulté le ).
- (en) Myra C. Hall, Peter Stiling, Daniel C. Moon et Bert G. Drake, « Effects of elevated CO2 on foliar quality and herbivore damage in a scrub oak ecosystem », Journal of Chemical Ecology, vol. 31, no 2, , p. 267–286 (ISSN 0098-0331 et 1573-1561, DOI 10.1007/s10886-005-1340-2, lire en ligne, consulté le ).
- (en) R. G. Knepp, J. G. Hamilton, A. R. Zangerl et M. R. Berenbaum, « Foliage of Oaks Grown Under Elevated Co2 Reduces Performance of Antheraea polyphemus (Lepidoptera: Saturniidae) », Environmental Entomology, vol. 36, no 3, , p. 609–617 (ISSN 0046-225X et 1938-2936, DOI 10.1093/ee/36.3.609, lire en ligne, consulté le ).
- (en) Huijuan Guo, Yucheng Sun, Yuefei Li et Bin Tong, « Pea aphid promotes amino acid metabolism both in Medicago truncatula and bacteriocytes to favor aphid population growth under elevated CO2 », Global Change Biology, vol. 19, no 10, , p. 3210–3223 (ISSN 1354-1013, DOI 10.1111/gcb.12260, lire en ligne, consulté le ).
- (en) Lewis H. Ziska, Jeffery S. Pettis, Joan Edwards et Jillian E. Hancock, « Rising atmospheric CO2 is reducing the protein concentration of a floral pollen source essential for North American bees », Proceedings of the Royal Society B: Biological Sciences, vol. 283, no 1828, , p. 20160414 (ISSN 0962-8452 et 1471-2954, DOI 10.1098/rspb.2016.0414, lire en ligne, consulté le ).
- (en) Jacqueline E. Mohan, Lewis H. Ziska, William H. Schlesinger et Richard B. Thomas, « Biomass and toxicity responses of poison ivy (Toxicodendron radicans) to elevated atmospheric CO2 », Proceedings of the National Academy of Sciences, vol. 103, no 24, , p. 9086–9089 (ISSN 0027-8424 et 1091-6490, DOI 10.1073/pnas.0602392103, lire en ligne, consulté le ).
- (en) John M. Landosky et David N. Karowe, « Will chemical defenses become more effective against specialist herbivores under elevated CO2 », Global Change Biology, vol. 20, no 10, , p. 3159–3176 (ISSN 1354-1013, DOI 10.1111/gcb.12633, lire en ligne, consulté le ).
- (en) Matthew L. Forister, « Monarchs and Milkweed: A Migrating Butterfly, a Poisonous Plant, and Their Remarkable Story of Coevolution. By Anurag Agrawal. Princeton (New Jersey): Princeton University Press. $29.95. xi + 283 p.; ill.; index. (ISBN 9780691166353). 2017. », The Quarterly Review of Biology, vol. 93, no 1, , p. 32–32 (ISSN 0033-5770 et 1539-7718, DOI 10.1086/696745, lire en ligne, consulté le ).
- (en) Megan K Bartlett et Gabriela Sinclair, « Temperature and evaporative demand drive variation in stomatal and hydraulic traits across grape cultivars », Journal of Experimental Botany, vol. 72, no 5, , p. 1995–2009 (ISSN 0022-0957 et 1460-2431, DOI 10.1093/jxb/eraa577, lire en ligne, consulté le ).
- (en) Emily A. Robinson, Geraldine D. Ryan et Jonathan A. Newman, « A meta‐analytical review of the effects of elevated CO2on plant–arthropod interactions highlights the importance of interacting environmental and biological variables », New Phytologist, vol. 194, no 2, , p. 321–336 (ISSN 0028-646X et 1469-8137, DOI 10.1111/j.1469-8137.2012.04074.x, lire en ligne, consulté le ).
- (en) Michael Aucott, « Are Changes in Plants due to Enhanced CO2 Contributing to Insect Population Declines? », Environmental Entomology, vol. 48, no 2, , p. 274–275 (ISSN 0046-225X et 1938-2936, DOI 10.1093/ee/nvz021, lire en ligne, consulté le ).
- Dufresnoy, André Ignace Joseph (1799). Des caractères de traitement et de la cure des dartres. Méquignon, Snr.. voir notamment p8 |https://www.google.fr/books/edition/Des_caractères_de_traitement_et_de_la_c/EXQ_AAAAcAAJ?hl=fr&gbpv=1&dq=inauthor:%22André+Ignace+Joseph+Dufresnoy%22&printsec=frontcover
- André Ignace Joseph Dufresnoy, Des caractères de traitement et de la cure des dartres, Méquignon, Snr., (lire en ligne)
- (en) Peter J. Frosch, Torkil Menné et Jean-Pierre Lepoittevin, Contact dermatitis, Berlin, Heidelberg, New York, Springer, , 4e éd., 1136 p. (ISBN 3-540-24471-9, OCLC 62901138, SUDOC 119358018, présentation en ligne).
- (en) Nancy P. Lee et Edgar R. Arriola, « Poison ivy, oak, and sumac dermatitis », The Western journal of medicine, vol. 171, nos 5-6, , p. 354-355 (ISSN 0093-0415, e-ISSN 1476-2978, PMID 10639874, PMCID PMC1308758, S2CID 20105460, lire en ligne).
- (en) Lofgran T et Mahabal G (2021) Toxicodendron Toxicity. StatPearls |URL=https://www.ncbi.nlm.nih.gov/books/NBK557866/#article-27288.r1
- (en) Mark A. Pittman et David R. Lane, « Black Spot Poison Ivy: Under the Cover Of Darkness », The Journal of Emergency Medicine, vol. 44, no 4, , e331–e332 (DOI 10.1016/j.jemermed.2012.11.062, lire en ligne, consulté le )
- (en) Karyn Haitz, Anar Mikailov et Joi Carter, « Black linear streaks on the face with pruritic plaques on the trunk and arms », Cutis, vol. 99, no 5, , E5–E6 (ISSN 2326-6929, PMID 28632804, lire en ligne, consulté le )
- (en) Ryan K. Rader, Ruipu Mu, Honglan Shi et William V. Stoecker, « Dermoscopy of black-spot poison ivy », Dermatology Online Journal, vol. 18, no 10, , p. 8 (ISSN 1087-2108, PMID 23122015, lire en ligne, consulté le )
- (en) J. G. Kurlan et A. W. Lucky, « Black spot poison ivy: A report of 5 cases and a review of the literature », Journal of the American Academy of Dermatology, vol. 45, no 2, , p. 246–249 (ISSN 0190-9622, PMID 11464186, DOI 10.1067/mjd.2001.114295, lire en ligne, consulté le )
- (en) Jonathan N. W. A. Barker, « Role of keratinocytes in allergic contact dermatitis », Contact Dermatitis, vol. 26, no 3, , p. 145-148 (ISSN 0105-1873, e-ISSN 1600-0536, OCLC 5153632502, PMID 1505178, DOI 10.1111/j.1600-0536.1992.tb00283.x, S2CID 8569103, lire en ligne).
- (en) Thomas S. Kupper, « Production of Cytokines by Epithelial Tissues: A New Model for Cutaneous Inflammation », The American Journal of Dermatopathology, vol. 11, no 1, , p. 69–73 (ISSN 0193-1091, DOI 10.1097/00000372-198902000-00011, lire en ligne, consulté le )
- (en) « Toxicodendron Dermatitis (Poison Oak, Poison Ivy, Poison Sumac; Also Known as Rhus Dermatitis) », dans Dermatology Skills for Primary Care: An Illustrated Guide, Humana Press, (ISBN 978-1-59259-906-6, DOI 10.1385/1-59259-906-0:191, lire en ligne), p. 191–197
- (en) Poison ivy, poison oak, and poison sumac (lire en ligne).
- (en) RL Baer, « Poison ivy dermatitis », Journal of Ethnopharmacology, vol. 19, no 3, , p. 339 (ISSN 0378-8741, DOI 10.1016/0378-8741(87)90025-0, lire en ligne, consulté le )
- (en) William L. Epstein, « Occupational Poison Ivy and Oak Dermatitis », Dermatologic Clinics, vol. 12, no 3, , p. 511–516 (ISSN 0733-8635, DOI 10.1016/s0733-8635(18)30155-4, lire en ligne, consulté le )
- (en) Jerry Oltman et Hensler Robert, « Poison oak/ivy and forestry workers », Clinics in Dermatology, vol. 4, no 2, , p. 213–216 (ISSN 0738-081X, DOI 10.1016/0738-081x(86)90081-7, lire en ligne, consulté le )
- (en) M. Rademaker et M. B. Dunffill, « Toxicodendron succedaneum(Rhus tree), New Zealand's poison ivy », Contact Dermatitis, vol. 33, no 5, , p. 357–358 (ISSN 0105-1873, DOI 10.1111/j.1600-0536.1995.tb02061.x, lire en ligne, consulté le ).
- (en) Nicolas Gaudenzio, Thomas Marichal, Stephen J. Galli et Laurent L. Reber, « Genetic and Imaging Approaches Reveal Pro-Inflammatory and Immunoregulatory Roles of Mast Cells in Contact Hypersensitivity », Frontiers in Immunology, vol. 9, , p. 1275 (ISSN 1664-3224, PMID 29922295, PMCID PMC5996070, DOI 10.3389/fimmu.2018.01275, lire en ligne, consulté le ).
- (en) Thomas W. McGovern et Theodore M. Barkley, « Botanical dermatology », International Journal of Dermatology, vol. 37, no 5, , p. 321-334 (ISSN 0011-9059, e-ISSN 1365-4632, OCLC 5154295605, PMID 9620476, DOI 10.1046/j.1365-4362.1998.00385.x).
- (en) Arkadiusz Kozubek et John HP Tyman, Studies in Natural Products Chemistry, vol. 30, Elsevier, coll. « Bioactive Natural Products (Part K) », (lire en ligne), p. 111–190.
- (en) Ian S. Dunn, Daniel J. Liberato, Reg G. Dennick et Neal Castagnoli, « A murine model system for contact sensitization to poison oak or ivy urushiol components », Cellular Immunology, vol. 68, no 2, , p. 377–388 (ISSN 0008-8749, DOI 10.1016/0008-8749(82)90122-8, lire en ligne, consulté le )
- (en) Jean-Luc Stampf, Neal Castagnoli, William Epstein et Robert W Baldwin, « Suppression of Urushiol-Induced Delayed-Type Hypersensitivity Responses in Mice with Serum IgG Immunoglobulin form Human Hyposensitized Donors », Journal of Investigative Dermatology, vol. 95, no 3, , p. 363–365 (ISSN 0022-202X, DOI 10.1111/1523-1747.ep12485146, lire en ligne, consulté le ).
- (en) Yesul Kim, Alexandra Flamm, Mahmoud A. ElSohly et Daniel H. Kaplan, « Poison Ivy, Oak, and Sumac Dermatitis: What Is Known and What Is New? », Dermatitis, vol. 30, no 3, , p. 183–190 (ISSN 2162-5220 et 1710-3568, DOI 10.1097/der.0000000000000472, lire en ligne, consulté le )
- (en) Nan An, Selma Pourzal, Stefano Luccioli et Stanislav Vukmanović, « Effects of diet on skin sensitization by nickel, poison ivy, and sesquiterpene lactones », Food and Chemical Toxicology, vol. 137, , p. 111137 (DOI 10.1016/j.fct.2020.111137, lire en ligne, consulté le ).
- (en) Henry N. Claman, Stephen D. Miller, Man-Sun Sy et John W. Moorhead, « Suppressive Mechanisms Involving Sensitization and Tolerance in Contact Allergy », Immunological Reviews, vol. 50, no 1, , p. 105–132 (ISSN 0105-2896 et 1600-065X, DOI 10.1111/j.1600-065x.1980.tb00309.x, lire en ligne, consulté le )
- (en) Tina L. Tanner, « Rhus (Toxicodendron) dermatitis », Primary Care: Clinics in Office Practice, vol. 27, no 2, , p. 493–502 (DOI 10.1016/S0095-4543(05)70209-8, lire en ligne, consulté le ).
- Santé Canada, « Herbe à puce », sur canada.ca, (consulté le )
- (en) J. F. Moe, « How much steroid for poison ivy? », Postgraduate Medicine, vol. 106, no 4, , p. 21, 24 (ISSN 0032-5481, PMID 10533503, lire en ligne, consulté le )
- (en) John Goodall, « Oral corticosteroids for poison ivy dermatitis », CMAJ: Canadian Medical Association journal = journal de l'Association medicale canadienne, vol. 166, no 3, , p. 300–301 (ISSN 0820-3946, PMID 11868634, lire en ligne, consulté le )
- (en) Hazel J. Vernon et Elise A. Olsen, « A controlled trial of clobetasol propionate ointment 0.05% in the treatment of experimentally induced Rhus dermatitis », Journal of the American Academy of Dermatology, vol. 23, no 5, , p. 829–832 (DOI 10.1016/0190-9622(90)70297-U, lire en ligne, consulté le ).
- (en) Wilfred E. Wooldridge, « Acute allergic contact dermatitis: How to manage severe cases », Postgraduate Medicine, vol. 87, no 4, , p. 221–224 (ISSN 0032-5481 et 1941-9260, DOI 10.1080/00325481.1990.11704608, lire en ligne, consulté le ).
- (en) Robert T. Brodell et Lynn Williams, « Taking the itch out of poison ivy: Are you prescribing the right medication? », Postgraduate Medicine, vol. 106, no 1, , p. 69–70 (ISSN 0032-5481 et 1941-9260, DOI 10.3810/pgm.1999.07.614, lire en ligne, consulté le ).
- (en) J. D. Guin, « Treatment of toxicodendron dermatitis (poison ivy and poison oak) », Skin Therapy Letter, vol. 6, no 7, , p. 3–5 (ISSN 1201-5989, PMID 11376396, lire en ligne, consulté le ).
- (en) James G Marks, Joseph F Fowler, Elizabeth F Sherertz et Robert L Rietschel, « Prevention of poison ivy and poison oak allergic contact dermatitis by quaternium-18 bentonite », Journal of the American Academy of Dermatology, vol. 33, no 2, , p. 212–216 (DOI 10.1016/0190-9622(95)90237-6, lire en ligne, consulté le )
- (en) Suzanne A. Grevelink, Dédée F. Murrell et Elise A. Olsen, « Effectiveness of various barrier preparations in preventing and/or ameliorating experimentally produced Toxicodendron dermatitis », Journal of the American Academy of Dermatology, vol. 27, no 2, , p. 182-188 (ISSN 0190-9622, OCLC 4929691569, PMID 1430354, DOI 10.1016/0190-9622(92)70167-E, S2CID 4832082).
- (en) John C. Craig, Coy W. Waller, Stephen Billets et Mahmoud A. Elsohly, New GLC Analysis of Urushiol Congeners in Different Plant Parts of Poison Ivy, Toxicodendron radicans, vol. 67, (DOI 10.1002/jps.2600670411, lire en ligne), p. 483–485.
- (en) Phuong N. Tran, Nicholas E. H. Tan, Yin Peng Lee et Han Ming Gan, « Whole-Genome Sequence and Classification of 11 Endophytic Bacteria from Poison Ivy ( Toxicodendron radicans ) », Genome Announcements, vol. 3, no 6, , e01319–15 (ISSN 2169-8287, PMID 26586879, PMCID PMC4653781, DOI 10.1128/genomeA.01319-15, lire en ligne, consulté le )
- (en) Toby Pirro et Stacy Pirro, « The complete genome sequence of Toxicodendron radicans, Eastern Poison Ivy », F1000Research, vol. 9, , p. 1015 (ISSN 2046-1402, DOI 10.12688/f1000research.25556.1, lire en ligne, consulté le ).
- (en) C. R. Bell, G. A. Dickie, W. L. G. Harvey et J. W. Y. F. Chan, « Endophytic bacteria in grapevine », Canadian Journal of Microbiology, vol. 41, no 1, , p. 46–53 (ISSN 0008-4166 et 1480-3275, DOI 10.1139/m95-006, lire en ligne, consulté le )
- (en) Stéphane Compant, Birgit Mitter, Juan Gualberto Colli-Mull et Helmut Gangl, « Endophytes of Grapevine Flowers, Berries, and Seeds: Identification of Cultivable Bacteria, Comparison with Other Plant Parts, and Visualization of Niches of Colonization », Microbial Ecology, vol. 62, no 1, , p. 188–197 (ISSN 0095-3628 et 1432-184X, DOI 10.1007/s00248-011-9883-y, lire en ligne, consulté le ).
- (en) Pablo R. Hardoim, Leo S. van Overbeek et Jan Dirk van Elsas, « Properties of bacterial endophytes and their proposed role in plant growth », Trends in Microbiology, vol. 16, no 10, , p. 463–471 (ISSN 0966-842X, DOI 10.1016/j.tim.2008.07.008, lire en ligne, consulté le ).
Voir aussi
Bibliographie
- Lyse Lefebvre, « La dermatite à Rhus », Bulletin d’information toxicologique, vol. 13, no 3, (ISSN 0829-5557, e-ISSN 1927-0801, lire en ligne). La plante y est citée sous le nom de Rhus radicans L.
Articles connexes
- Urushiol
- Lésion bulleuse
- Dermatose bulleuse
- Grande herbe à poux (qui pourrait dans les esprits être confondue avec l'herbe à puces)
Liens externes
- (en) Référence Flora of Missouri : Toxicodendron radicans
- (en) Référence Catalogue of Life : Toxicodendron radicans (L.) Kuntze (consulté le )
- (fr) Référence Tela Botanica (France métro) : Toxicodendron radicans (L.) Kuntze, 1891
- (fr+en) Référence ITIS : Toxicodendron radicans (L.) Kuntze
- (en) Référence NCBI : Toxicodendron radicans (taxons inclus)
- (en) Référence GRIN : espèce Toxicodendron radicans (L.) Kuntze
- Pourquoi 2 types d'herbes à la puce?
- Portail de la botanique
- Portail de la médecine
- Portail de la biologie