Hexafluorobenzène
L’hexafluorobenzène (HFB) est un composé chimique de formule C6F6. Il s'agit d'un composé organique aromatique dérivant formellement du benzène C6H6 par substitution des six atomes d'hydrogène par six atomes de fluor. Il possède peu d'applications techniques, bien qu'il soit recommandé comme solvant dans un certain nombre de réactions photochimiques. Au laboratoire, on l'utilise notamment :
- comme référence en RMN du fluor 19,
- comme solvant et référence en RMN du carbone 13,
- comme solvant dans certains domaines du spectre infrarouge et ultraviolet.
Pour les articles homonymes, voir HFB.
| Hexafluorobenzène | |||
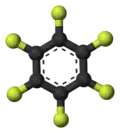 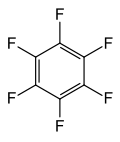 Structure de l'hexafluorobenzène |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Hexafluorobenzène | ||
| Synonymes |
perfluorobenzène |
||
| No CAS | |||
| No ECHA | 100.006.252 | ||
| No CE | 206-876-2 | ||
| No RTECS | DA3050000 | ||
| PubChem | 9805 | ||
| ChEBI | 38589 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore | ||
| Propriétés chimiques | |||
| Formule | C6F6 [Isomères] |
||
| Masse molaire[1] | 186,054 6 ± 0,004 8 g/mol C 38,73 %, F 61,27 %, |
||
| Propriétés physiques | |||
| T° fusion | 3,7 à 4,1 °C[2] | ||
| T° ébullition | 80 à 82 °C[2] | ||
| Paramètre de solubilité δ | 16,9 J1/2·cm-3/2 (25 °C)[3] | ||
| Masse volumique | 1,612 g·cm-3[2] à 25 °C | ||
| Point d’éclair | 10 °C[2] | ||
| Précautions | |||
| SGH[2] | |||
 Danger |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
La synthèse directe de l'hexafluorobenzène à partir du fluor F2 et du benzène C6H6 est impossible. En revanche, la synthèse de C6F6 par la réaction d'un fluorure alcalin sur du benzène halogéné a été publiée[4] :
Literature
- Walter J. Pummer, Leo A. Wall: « Reactions of Hexafluorobenzene », Science, 1958, Vol. 127, Nr. 3299, pp. 643–644; DOI:10.1126/science.127.3299.643.
- Harold Crosbie Fielding: « Preparation of hexafluorobenzene and fluorochlorobenzenes », US-Patent 3277192, 4. October 1966.
- M. D. Bertolucci, R. E. Marsh: « Lattice parameters of hexafluorobenzene and 1,3,5-trifluorobenzene at −17 °C », J. Appl. Cryst., 1974, 7, pp. 87–88; DOI:10.1107/S0021889874008764.
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Sigma Aldrich
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- (en) N. N. Vorozhtsov, V. E. Platonov et G. G. Yakobson, « Preparation of hexafluorobenzene from hexachlorobenzene », Russian Chemical Bulletin, vol. 12, no 8, , p. 1389 (lire en ligne) DOI:10.1007/BF00847820
- Portail de la chimie
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons - Attribution - Partage dans les Mêmes. Des conditions supplémentaires peuvent s'appliquer aux fichiers multimédias.
