Trioxyde de phosphore
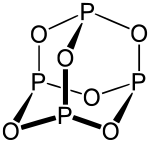
L'hexoxyde de tétraphosphore, ou oxyde de phosphore(III), est l'oxyde de phosphore ![]() P4O6. Ce composé a aussi été appelé sesquioxyde de phosphore et trioxyde de diphosphore (ou très souvent, par abus de langage, trioxyde de phosphore) parce qu'il a été longtemps connu sous la formule P2O3 ; il s'est avéré plus tard que la formule brute correcte est P4O6 (dimère).
P4O6. Ce composé a aussi été appelé sesquioxyde de phosphore et trioxyde de diphosphore (ou très souvent, par abus de langage, trioxyde de phosphore) parce qu'il a été longtemps connu sous la formule P2O3 ; il s'est avéré plus tard que la formule brute correcte est P4O6 (dimère).
| Trioxyde de phosphore | |
| |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.032.414 |
| PubChem | 123290 |
| ChEBI | 37372 |
| SMILES | |
| InChI | |
| Apparence | cristaux blancs d'aspect cireux |
| Propriétés chimiques | |
| Formule | P4O6 |
| Masse molaire[1] | 219,891 4 ± 0,001 8 g/mol O 43,66 %, P 56,34 %, |
| pKa | 9,4[réf. souhaitée] |
| Propriétés physiques | |
| T° fusion | 23,8 °C[2] |
| T° ébullition | 175,4 °C[2] |
| Solubilité | soluble dans beaucoup de solvants[2] mais réagit avec l'eau |
| Masse volumique | 2,135 g·cm-3[réf. souhaitée] |
| Unités du SI et CNTP, sauf indication contraire. | |
À l'état solide, ce composé très toxique[3] forme des cristaux blancs d'aspect cireux. C'est l'anhydride de l'acide phosphoreux H3PO3 : il réagit avec l'eau suivant la réaction P4O6 + 6 H2O → 4 H3PO3 ; en revanche il ne peut pas être obtenu par déshydratation de H3PO3.
Préparation
P4O6 est préparé directement à partir de P4, le phosphore blanc, isolé par Hennig Brandt en 1669.
Aujourd'hui, il est obtenu par oxydation contrôlée puis distillation sous une atmosphère composée à 75 % de O2 et 25 % de N2 à 50 °C et 90 mmHg :
Propriétés chimiques
D'après[2].
Comportement face à la chaleur
Quand le P4O6 est chauffé autour de 200-400 °C, il se décompose en phosphore rouge et dans une seconde phase qui contient des oxydes de phosphore P4On, avec n pouvant atteindre 10.
Hydrolyse
Comme indiqué dans l'introduction, P4O6 est l'anhydride de l'acide phosphoreux H3PO3 ; son hydrolyse dans l'eau froide donne donc l'acide phosphoreux selon la réaction :
Cela fonctionne aussi en le faisant réagir avec de l'acide chlorhydrique (HClaq) pour donner :
Ligand
P4O6 est aussi un ligand.
Il est entre autres capable de remplacer le monoxyde de carbone du complexe tétracarbonyle de nickel [Ni(CO)4] :
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) N.N. Greenwood, Chemistry of the Elements, Butterworth-Heinemann, , 1341 p. (ISBN 978-0-7506-3365-9, lire en ligne), p. 504.
- (en) A.F. Holleman, Egon Wiberg et Nils Wiberg, Inorganic Chemistry, Boston, Academic Press, (ISBN 0-12-352651-5).