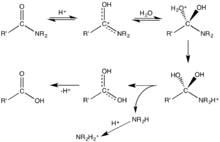
Hydrolyse
Une hydrolyse (du grec hydro : eau et lysis : briser) est une réaction chimique et enzymatique dans laquelle une liaison covalente est rompue par action d'une molécule d'eau.
Exemple :
- hydrolyse du saccharose : saccharose + eau → glucose + fructose : ce mélange porte le nom de sucre inverti ;
- hydrolyse d'un ester : ester + eau → alcool + acide carboxylique : en utilisant les formules semi-développées cette réaction peut s'écrire R1-COO-R2 + H2O → R2-OH + R1-COOH. La réaction inverse est l'estérification.
Effets biochimiques
Pour des substances organiques telles que les protéines, une hydrolyse équivaut à la coupure des liaisons peptidiques entre les différents acides aminés qui les constituent.
Les acides aminés sont coupés par les enzymes. Ainsi en est-il de l'hydrolyse de l’amidon ou amylolyse, utilisée en brasserie ou de manière générale dans l'industrie agroalimentaire pour obtenir du sirop de glucose.
À titre d'exemple, lors de la cuisson d'une viande, le collagène ne peut se transformer en gélatine qu'en présence d'eau.
Comme lorsqu'on prend du NaOH, il produit du gaz, il subit une transformation. (vérifier la formulation)
Risques, dangers
L'hydrolyse de l'eau peut conduire à un risque technologique d'explosion si l'hydrogène et l'oxygène se recombinent (en présence d'une flamme, d'une étincelle ou d'un élément très chaud ou de certains catalyseurs).
Dans le cas de la radiolyse, l'explosion d'hydrogène est un risque important dans les locaux de l’îlot nucléaire de certaines installations nucléaires où l'eau sert de fluide de refroidissement ou d'aspersion[1], dans un contexte exigeant un très haut niveau de sûreté[2]. En effet, en espace clos, la libération dans l'air de ce gaz hautement inflammable peut entraîner la formation d’une atmosphère inflammable, qui peut exploser et provoquer des graves dégâts, surtout en milieu clos et obturé comme on l'a vu lors de l'accident de Fukushima. Les phénomènes de dispersion et de déflagration induits par une fuite d’hydrogène sont étudiés pour mieux les modéliser et les éviter ou atténuer[2].
Des explosions ont été involontairement provoquées dans le corps humain lors de certaines opérations chirurgicales, notamment à l'occasion de manœuvres endoscopiques urologiques, quand un procédé d'électrocoagulation ou de résection (bistouri électrique) a hydrolysé l'eau présente dans un organe fermé (la vessie typiquement)[3]. La première explosion vésicale décrite[4] par la littérature médicale est survenue lors d'une électrocoagulation lors d'une résection transurétrale de la prostate. l'article date de 1926[5].
Substances hydrolysables
Presque toutes les macromolécules biologiques peuvent être hydrolysées, ce qui libère les monomères qui les constituent. Par exemple, les protéines peuvent être hydrolysées et libérer des acides aminés. Les polymères comme le glycogène peuvent être hydrolysés pour donner du glucose. L'ADN et l'ARN peuvent être hydrolysés pour libérer les nucléotides.
Parmi les fonctions hydrolysables, nous trouvons les esters, les acétals (présents dans les polysaccharides) et les amides (présents dans les protéines).
Taux de conversion d'une hydrolyse
L'hydrolyse d'un ester par de l'eau est une réaction lente et limitée. En effet, il se forme des produits qui sont des acides et des alcools, qui eux-mêmes réagissent ensemble dans le milieu réactionnel pour former à leur tour de l'ester et de l'eau. Le taux de conversion d'une hydrolyse d'ester lors de l'introduction des réactifs en quantités stœchiométriques est de l'ordre de 33 % quand il forme un alcool primaire, 40 % pour un secondaire et 95 % pour un tertiaire. Un excès d'eau déplace logiquement cet équilibre vers la formation de l'alcool.
Hydrolyse basique
L'hydrolyse basique est, comme son nom l'indique, une réaction d'hydrolyse. Mais, contrairement à une hydrolyse classique, l'eau est remplacée généralement par de la soude ou toute autre solution contenant des ions hydroxyde (comme de l'hydroxyde de potassium par exemple), d'où le nom d'hydrolyse basique car la réaction d'hydrolyse se déroule en milieu basique.
L'équation générale d'une réaction d'hydrolyse basique est la suivante :
L'ion carboxylate (contrairement à l'acide carboxylique formé lors d'une hydrolyse classique) est sans effet sur l'alcool de sorte que la réaction inverse d'estérification n'a pas lieu. Par conséquent une transformation d'hydrolyse basique est totale contrairement à une hydrolyse classique. Une hydrolyse basique est lente à température ambiante mais rapide à chaud.
Une application de l'hydrolyse basique est la formation de savons. En effet, les réactions de saponification à l'origine des savons ne sont autres que des réactions d'hydrolyse basique à partir de corps gras (qui sont des triesters du glycérol). Les savonnettes sont obtenues par précipitation de l'ion carboxylate obtenu lors de la saponification à l'aide de sodium ou de potassium. Les savons sont des carboxylates de sodium ou de potassium.
Notes et références
- Cristina Ghitiu, « Évaluation de l'effet de l'aspersion sur les pressions et températures dans l'enceinte de confinement des réacteurs à eau pressurisée français en conditions accidentelles », Thèse, Université de Lyon, (lire en ligne, consulté le )
- De Stefano Maria (2018) Explosion d'un mélange hétérogène hydrogène-air dans un milieu clos obstrué (PDF, Thèse de Doctorat, EDF, Laboratoire Pluridisciplinaire de Recherche en Ingénierie des Systèmes, Mécanique, Énergétique (PRISME), Institut National des Sciences Appliquées-Centre Val de Loire)
- Davis TR (1983) The composition and origin of the gas produced during urological endoscopic resections.|Br J Urol. Juin ; 55(3):294-7.
- Cassuto A. Explosion dans la vessie au cours d’une électro-coagulation. J Urol. 1926;22:263.
- El Anzaoui, J., & Abakka, N. (2013). L’explosion intravésicale au cours des procédures de résection endoscopique: Un incident dangereux qui peut être évité. Canadian Urological Association Journal, 7(7-8), E517.|URL=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3713156/.
Voir aussi
Articles connexes
Bibliographie
- Portail de la chimie