Ferritine
La ferritine est une protéine permettant le stockage du fer. Elle joue un rôle clé dans le métabolisme du fer, permettant de réguler son absorption intestinale en fonction des besoins de l'organisme. Elle a ainsi une fonction de réserve et de détoxication du fer. Le dosage de la ferritine plasmatique est le reflet des réserves tissulaires mobilisables. Son dosage permet d'évaluer les réserves en fer et ainsi de dépister précocement une carence en fer ou à l'opposé d'apprécier une remontée des réserves lors d'un traitement par supplémentation ferrique.
| Ferritine | ||
 Structure de la ferritine constituée de 24 sous-unités. L'une des chaînes est soulignée en violet (PDB 1LB3). | ||
| Caractéristiques générales | ||
|---|---|---|
| N° EC | 1.16.3.1 | |
| Gène FTL – Chaîne légère | ||
| Homo sapiens | ||
| Locus | 19q13.33 | |
| Masse moléculaire | 20 020 Da[1] | |
| Nombre de résidus | 175 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Gène FTH1 – Chaîne lourde 1 | ||
| Homo sapiens | ||
| Locus | 11q12.3 | |
| Masse moléculaire | 21 226 Da[1] | |
| Nombre de résidus | 183 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Ferritine mitochondriale | ||
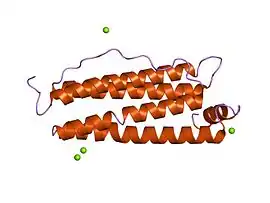 Chaîne de ferritine mitochondriale humaine (PDB 1R03) | ||
| Caractéristiques générales | ||
| Symbole | FTM | |
| N° EC | 1.16.3.1 | |
| Homo sapiens | ||
| Locus | 5q23.1 | |
| Masse moléculaire | 27 538 Da[1] | |
| Nombre de résidus | 242 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Pfam | PF00210 |
|---|---|
| Clan Pfam | CL0044 |
| InterPro | IPR008331 |
| SCOP | 1fha |
| SUPERFAMILY | 1fha |
On la trouve dans le colostrum et la protéine de petit-lait, semble jouer des rôles biologiques très divers et est considérée comme la première ligne de défense immunitaire de l’organisme. Par sa très forte affinité avec le fer, elle favorise son absorption par la muqueuse intestinale des nouveau-nés. Elle a également des propriétés antibactériennes, antivirales, antifongiques, anti-inflammatoires, antioxydantes et immunomodulatrices.
Les plantes en possèdent aussi (phytoferritine), mais leur rôle est moins bien compris.
Structure
La ferritine est une protéine constituée de 24 sous-unités qui s'assemblent pour former une coquille creuse, de manière analogue à la capside de certains virus[2]. Suivant les espèces, on peut trouver soit un seul type (chez les plantes), soit deux types de sous-unités de ferritine. En particulier, chez les vertébrés, ces sous-unités se divisent en deux types ayant 50 % d'homologie[2] : sous-unité lourde (nommée H pour heavy) et sous-unité légère (nommée L pour light). Ces deux sous-unités ont, respectivement, une masse moléculaire de 19 kDa et 21 kDa. La masse moléculaire de la protéine est d'environ 474 kDa.
Le diamètre intérieur de cette coquille est de 8 nm et son diamètre extérieur est de 12 nm[3]. La coquille constituée par cet assemblage permet de stocker le fer à l'intérieur sous forme de cristallites, avec des ions phosphate et/ou hydroxyde. La particule résultante ressemble à un oxyhydroxyde de fer minéral. Chaque molécule de ferritine peut contenir jusqu'à 4500 atomes de fer sous forme ferrique (Fe3+)[3].
L'entrée de fer dans l'apo-ferritine (c'est-à-dire « ferritine ne contenant pas de fer ») dépend de l'activité ferroxydase de la sous-unité H[4]. Il est probable que la sortie du fer hors de la ferritine ne nécessite pas de machinerie extérieure spécifique[5].
Régulation
La régulation de l'expression des gènes codant la ferritine est contrôlée par un mécanisme de régulation post-transcriptionnelle faisant intervenir une structure en épingle à cheveux spécifique qui est nommé IRE[6]. Cette structure est située dans la région 5'-UTR de son ARN messager. En situation de carence en fer, les protéines régulatrices du fer (aussi nommées IRP) viennent se fixer sur cet IRE et inhibent la traduction de l'ARN messager en protéine.
La synthèse de la ferritine est aussi régulée au niveau transcriptionnel par la présence d'un élément de réponse antioxydant (ARE) situé dans la partie 5'-UTR des gènes des sous-unités L et H de la ferritine[7].
Concentrations physiologiques chez l'humain
Valeurs normales
Les valeurs de référence sont plus élevées chez l'homme que chez la femme.
- Homme : 20 à 310 μg·L-1
- Femme : 20 à 204 μg·L-1
- après la ménopause : 20 à 250/300 μg·l-1
Une étude remet en question les valeurs de références de la ferritine, avançant qu'avoir des valeurs de référence différentes concernant la ferritine pour les hommes et les femmes n'est pas justifié[8].
Variations physiologiques
- Avec l'âge : Les concentrations de ferritine sont particulièrement élevées à la naissance (400 μg·l-1) et le taux maximum est atteint vers deux mois de vie (600 μg·l-1). Puis on observe une diminution pour atteindre les taux adultes physiologiques après la puberté. Chez l'homme, la médiane augmente de 23 μg·l-1 avant l'adolescence pour atteindre un plateau à 120 μg·l-1 après 32 ans. Chez la femme, le taux reste stable aux alentours de 30 μg·l-1 jusqu'à la ménopause et progresse ensuite jusqu'à 80 μg·l-1.
- Avec le sexe : taux plus élevés chez l'homme que chez la femme, avant la ménopause.
- Avec la grossesse : diminution du taux lors de la grossesse, surtout lors du 3e trimestre.
- Avec l'exercice physique : diminution du taux lors d'exercice physique intensif et régulier.
Diminution = hypoferritinémie
Une diminution du taux de ferritine (hypoferritinémie), particulièrement érythrocytaire, est observée le plus souvent dans le cadre d'une anémie microcytaire. Il se rencontre dans de nombreuses causes, physiologique ou pathologique :
- Hémorragies
- gynécologiques
- occultes
- dons de sang répétés ou rapprochés
- Carence en fer : baisse de la ferritine très précoce, avant l'installation de l'anémie
- Patients sous hémodialyse
- Régime alimentaire déséquilibré
- Grossesses multiples rapprochées
Les traitements peuvent être administrés par voir orale (complexe fer hydroxyde-polymaltose) ou parentérale (carboxymaltose ferrique).
Augmentation = hyperferritinémie
Il y a hyperferritinémie, c'est-à-dire élévation anormale du taux de ferritine plasmatique lorsque ce taux est supérieur à 300 μg·l-1 chez l’homme et à 200 μg·l-1 chez la femme.
Cette augmentation du taux de ferritine sanguin est principalement due à une surcharge en fer intracellulaire, à une cytolyse hépatique, une inflammation ou une prise d'alcool.
L'hyperferritémie peut être classée suivant l'existence ou non d'une surcharge en fer[9] :
- avec surcharge en fer
- sans surcharge en fer
- alcoolisme
- hépatosidérose dysmétabolique
- syndromes infectieux et inflammatoires, qui au dessus de 500 μg·l-1 traduit très probablement un syndrome de tempête de cytokine, pouvant rapidement conduire à une défaillance multi-organes et à la mort, sans traitement rapide.
- cytolyse hépatique aiguë (hépatite) ou cirrhose
- anémies hémolytiques, sidéroblastiques, thalassémies ou par dysérythropoïèse (perturbation de la fabrication des globules rouges).
- tumeurs (cancer du foie, cancer du poumon, cancer du pancréas, cancer du sein, cancer du rein) et hémopathies (leucémies aiguës, maladie de Hodgkin)
- maladie de Gaucher
Notes et références
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- (en) E.C. Theil, « Ferritin: structure, gene regulation, and cellular function in animals, plants, and microorganisms », Annu. Rev. Biochem, vol. 56, , p. 289-315 (PMID 3304136, DOI 10.1146/annurev.bi.56.070187.001445).
- (en) N. Dennis Chasteen et Pauline M. Harrison, « Mineralization in ferritin: an efficient means of iron storage », J. Struct. Biol, vol. 126, , p. 182--194 (DOI 10.1006/jsbi.1999.4118)
- (en) D. M. Lawson, A. Treffry et al., « Identification of the ferroxidase centre in ferritin », FEBS Lett., vol. 254, nos 1-2, , p. 207-210
- (en) Ivana De Domenico, Michael B. Vaughn et al., « Ferroportin-mediated mobilization of ferritin iron precedes ferritin degradation by the proteasome », EMBO J., vol. 25, no 22, , p. 5396-5404. (DOI 10.1038/sj.emboj.7601409).
- J.C. Dreyfus, « Régulation par le fer de la biosynthèse de la ferritine et du récepteur de la transferrine », Médecine/sciences, vol. 8, , p. 527-528 (lire en ligne).
- (en) J.C. Salgado, A. Olivera-Nappa et al., « Mathematical modeling of the dynamic storage of iron in ferritin », BMC Syst. Biol, vol. 4, , p. 147.
- « What is the evidence for gender differences in ferritin and haemoglobin? » (consulté le )
- Koperdanova M, Cullis JO, Interpreting raised serum ferritin levels, BMJ, 2015;351:h3692
Voir aussi
Bibliographie
- N. Belfeki, A. Strazzulla, S. Abroug, M. Picque et S. Diamantis, « Les hyperferritinémies majeures : un facteur de mauvais de pronostic ? », La revue de médecine interne, vol. 40, no S1, , p. A104 (OCLC 8114175262, DOI 10.1016/j.revmed.2019.03.098).
- Brissot P, Lorho R, Ghyades D, Moirand R & Loréal O (2006). Que faire devant une hyperferritinémie? | Tirés à part: Pierre Brissot, Service des maladies du foie, hôpital Pontchaillou-Rennes. 24e Journées nationales de formation continue en hépato-gastroentérologie des, 18.
- Brissot P (2007) Diagnostic d'une hyperferritinémie. Revue du Praticien ; Médecine générale, 21(776/777), 657.
- Deugnier Y (2011) Prise en charge de l’hyperferritinémie | Gan, 31(260), 71.
- Lorcerie, B., Audia, S., Samson, M., Millière, A., Falvo, N., Leguy-Seguin, V., ... & Bonnotte, B. (2015) Démarche diagnostique devant une hyperferritinémie | La Revue de médecine interne, 36(8), 522-529.
- Serraj, K., Alaoui, H., Hamaz, S., Mourot-Cottet, R., Keller, O., & Andrès, E. (2015). Démarche diagnostique devant une hyperferritinémie. Médecine thérapeutique, 21(4), 298-304.
Articles connexes
Liens externes
- Portail de la biologie cellulaire et moléculaire
- Portail de la médecine