2-Méthylbutane
Le 2-méthylbutane est un alcane saturé de formule brute C5H12. Il est un des isomères structuraux du pentane.
| 2-méthylbutane | ||
| ||
 | ||
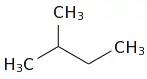
| Formule et représentation 3D de l'isopentane | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 2-méthylbutane | |
| Synonymes |
isopentane |
|
| No CAS | ||
| No ECHA | 100.001.039 | |
| No CE | 201-142-8 | |
| PubChem | 6556 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide incolore, d'odeur caractéristique[1] | |
| Propriétés chimiques | ||
| Formule | C5H12 [Isomères] |
|
| Masse molaire[2] | 72,148 8 ± 0,004 8 g/mol C 83,24 %, H 16,76 %, |
|
| Moment dipolaire | 0,13 ± 0,05 D[3] | |
| Diamètre moléculaire | 0,542 nm[4] | |
| Propriétés physiques | ||
| T° fusion | −159,9 °C[5] | |
| T° ébullition | 28 °C[5] | |
| Solubilité | 48 mg·l-1 (eau,20 °C)[5] | |
| Paramètre de solubilité δ | 13,8 J1/2·cm-3/2 (25 °C)[4] | |
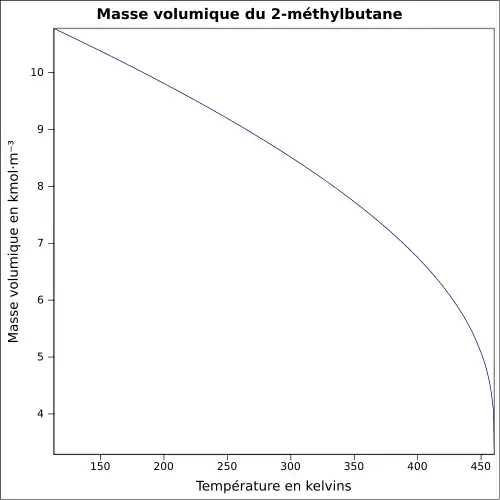
| Masse volumique | 0,619 2 g·cm-3[6]
|
|
| T° d'auto-inflammation | 420 °C[5] | |
| Point d’éclair | −51 °C[5] | |
| Limites d’explosivité dans l’air | 1,3–7,6 %vol 38–230 g·m-3[5] |
|
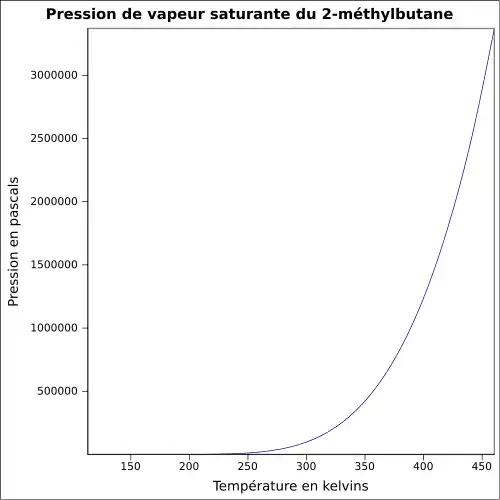
| Pression de vapeur saturante | 0,761 bar à 20 °C 1,1 bar à 30 °C 2,042 bar à 50 °C[5] |
|
| Point critique | 33,8 bar, 187,85 °C, 0,306 mol·l-1[8] | |
| Thermochimie | ||
| S0liquide, 1 bar | 260,41 J·mol-1·K-1[8] | |
| ΔfH0gaz | −153,7 kJ·mol-1[8] | |
| ΔfH0liquide | −178,2 kJ·mol-1[8] | |
| ΔfusH° | 5,155 kJ·mol-1 à −159,78 °C[8] | |
| ΔvapH° | 25,22 kJ·mol-1 à 25 °C 24,69 kJ·mol-1 à 27,85 °C[8] |
|
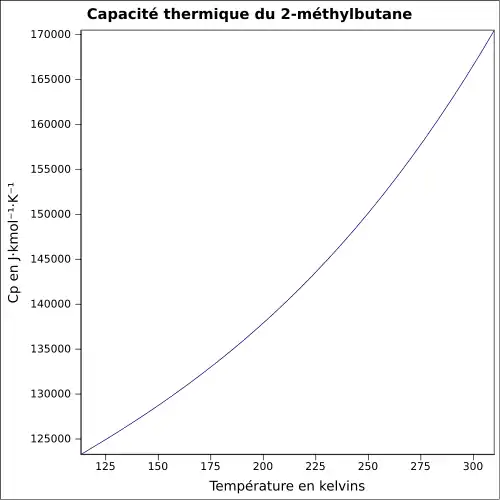
| Cp | 118,9 J·mol-1·K-1 (25 °C, gaz) 164,5 J·mol-1·K-1 (25,15 °C, liquide)[8] |
|
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 10,32 ± 0,05 eV (gaz)[10] | |
| Propriétés optiques | ||
| Indice de réfraction | 1,3509[4] | |
| Précautions | ||
| SGH[11] | ||
    Danger |
||
| SIMDUT[12] | ||
 B2, |
||
| NFPA 704 | ||
| Transport | ||
| Écotoxicologie | ||
| LogP | 2,3[1] | |
| Seuil de l’odorat | bas : 400 ppm[13] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Utilisation
L'isopentane est utilisé pour la synthèse industrielle de l'isoprène via la déshydrogénation oxydative. Deux procédés existent : le premier en une étape est une adaptation du procédé Houdry avec l'alumine comme catalyseur. Le rendement est de 52 % à une température de 600 °C et à une pression de 7 kPa[14]. Le deuxième procédé est constitué de deux étapes.
La synthèse du 2-méthylbutan-2-ol utilise également l'isopentane comme réactif avec un catalyseur de cobalt et de molybdène[15].
La production du caoutchouc synthétique utilise le 2-méthylbutane comme solvant pour sa propriété anti-polymérisation.
Notes et références
- ISOPENTANE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons, , 239 p. (ISBN 978-0-471-98369-9)
- Entrée « 2-Methylbutane » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 20 avril 2009 (JavaScript nécessaire)
- (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, New York, McGraw-Hill, , 16e éd., 1623 p. (ISBN 978-0-07-143220-7), p. 2.289
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 978-0-07-049841-9), p. 2-50
- (en) « Butane, 2-methyl- », sur NIST/WebBook, consulté le 20 avril 2009
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 2, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 978-0-88415-858-5)
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Isopentane » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Isopentane », sur hazmap.nlm.nih.gov (consulté le )
- Hans Martin Weitz et Eckhard Loser, Ullmann's Encyclopedia of Industrial Chemistry, Isoprene, Wiley-VCH Verlag,
- Peter Lappe et Thomas Hofmann, Ullmann's Encyclopedia of Industrial Chemistry, Pentanols, Wiley-VCH Verlag,
- Portail de la chimie