Isotherme de compression
Un isotherme de compression est un diagramme représentant la variation de la pression de surface (mN/m) en fonction de l'aire moléculaire (Å2/molécule) pendant la compression d'une monocouche à température constante. Il est obtenu grâce à une balance de Langmuir.
Mesure
La mesure s'effectue sur une balance de Langmuir. La cuve est remplie d'eau pure ou d'une solution aqueuse à la surface de laquelle est étalée une monocouche (généralement lipidique). Puisque l'on connaît la surface totale de la sous-phase et la quantité de composé déposé, on calcule aisément l'aire moléculaire en divisant le nombre de molécules par la surface totale en Å2. On comprime alors la monocouche en réduisant la surface disponible grâce à la barrière mobile à une vitesse de l'ordre de 2 Å2/molécule/min tout en mesurant, en continu, la tension superficielle γ et en tirant la pression de surface π = (γ0 – γ), avec γ0 la tension superficielle mesurée avant l'étalement de la monocouche.
La mesure s'arrête lorsque le collapse est atteint ou, à défaut, lorsque la barrière mobile entre en contact avec la plaque de Wilhelmy.
Isotherme
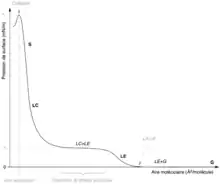
Phases et transitions
Plusieurs phases peuvent être détectées et sont séparées par des transitions de phase durant lesquelles la pression de surface ne change pas, ou peu, alors que l'aire moléculaire augmente ou diminue. C'est également ce que l'on observe en trois dimensions dans les transitions de phase normales avec un volume qui change alors que la pression reste stable.
Les phases bidimensionnelles sont, dans l'ordre croissant de pression de surface :
- La phase gazeuse (G) : il y a peu de molécules par unité de surface et il y a peu d'interactions entre elles ;
- La phase liquide expansé (LE) ;
- La phase liquide condensé (LC) ;
- La phase solide (S) ;
et, parfois, une phase dite cristalline qui englobe les phases liquide-condensé et solide (LC+S).
L'isotherme de compression ne permet pas d'observer les transitions G→LE ou LC→S.
Points remarquables
Si l'on comprime la phase solide, on arrive à un point où les molécules de la monocouche ne peuvent plus se réarranger les unes par rapport aux autres pour absorber l'excès de pression ce qui entraîne la destruction de la monocouche, appelée le collapse : certaines parties de la monocouche vont former des micelles, des multicouches, des liposomes qui passent dans la phase aqueuse. On utilise un autre anglicisme, le lift-off (littéralement "décollage"), pour désigner l'aire moléculaire pour laquelle on observe la première hausse de la pression de surface.
L'aire moléculaire au collapse détermine l'aire spécifique du constituant de la monocouche, c'est-à-dire la surface minimum qu'une molécule de ce composé occupe à la surface dans l'état le plus dense de la monocouche.
La pression de surface de la transition de phase principale (π t sur le schéma) est la pression à laquelle s'effectue la transition liquide-solide. Cette valeur dépend de trois facteurs : la substance composant la monocouche, la température et la composition de la sous-phase. En répétant l'expérience à des températures différentes, on peut déterminer la température à partir de laquelle la transition de phase principale disparait ; c'est ce que l'on nomme la température de transition de phase principale. On peut considérer cette grandeur comme l'équivalent bidimensionnel de la température de fusion d'une substance.
La pression de surface au collapse et l'aire moléculaire au lift-off sont deux valeurs importantes mais délicates à interpréter et sont généralement utilisées comme des valeurs relatives lors de la comparaison d'une famille de composés proches plutôt que comme des grandeurs absolues.
Références
- Portail de la physique