Jonction serrée
Les jonctions serrées ou étanches ou imperméables ou occlusives (dites zonula occludens) sont caractéristiques des tissus épithéliaux du taxon des chordés. Elles bloquent la circulation de fluides entre les cellules (voie paracellulaire) et assurent ainsi l'étanchéité entre deux compartiments tissulaires. Cependant, elle peut laisser passer certains peptides, plutôt hydrophiles de petite taille (< 15 nm), notamment au niveau du tube digestif lors de la digestion. Les éléments principaux contribuant à la formation de cette jonction sont deux protéines nommées claudine (du latin : claudere, fermer) et occludine. Les zonula occludens se nomment tight junction en Anglais. Sans ces barrières paracellulaires, il ne serait pas possible de maintenir les propriétés du milieu au sein de compartiments donnés, comme la grande acidité (pH de 1 à 2) de l’intérieur de l’estomac.
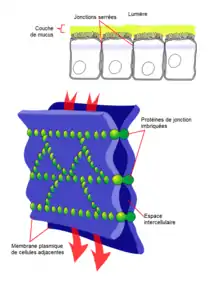
Structure
Les jonctions serrées sont localisées à l'apex des cellules épithéliales où elles forment une bande continue tout autour qui assure l'étanchéité. Au microscope, quand on sépare les deux membranes cellulaires, on observe une série de bourrelets longilignes, plus ou moins interconnectés mais jamais interrompus. Les deux membranes comportent exactement le même réseau de bourrelets. Ces bourrelets sont complémentaires de sillons visibles sur la face interne de la membrane plasmique. La signification de cette structure n'a pas été comprise de suite ; elle a été d'abord identifiée comme des protéines linéaires qui assurent l'étanchéité. Il n'en est rien. Si des protéines participent à la régulation et la stabilité de la structure, comme les CAM cadhérines ou encore les CAM de la superfamille des immunoglobulines, elles n'en constituent pas le cœur.
En fait, il s'agit d'une fusion partielle des membranes plasmiques : au niveau des jonctions, les hémimembranes extracytoplasmiques disparaissent et les deux hémimembranes cytoplasmiques s'associent pour reconstituer une membrane, complète, mais composée d'éléments provenant des deux cellules. Au niveau des épithéliums polarisés interviennent des protéines à quatre domaines transmembranaires et à domaine extracellulaire court: les claudines et les occludines. Ces protéines permettent le rapprochement des deux membranes plasmiques, elles sont connectées à ZO1, ZO2 et ZO3. Les jonctions serrées sont reliés aux filaments d'actine par l'intermédiaire de la cinguline, ou de la spectrine (suivant les ouvrages rencontrés).
Fonctions
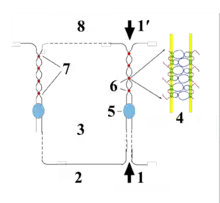
La principale fonction est d'assurer l'étanchéité des épithéliums, tels que celui qui sépare l'intérieur et l'extérieur de l'intestin, ou encore d'éviter que l'organisme ne se vide de son eau par les multiples épithéliums en contact avec le milieu extérieur tels que la peau, le tube digestif, voire l'épithélium germinatif. En revanche, les épithéliums qui doivent facilement être traversés, comme l'endothélium vasculaire, en sont totalement dépourvus, sauf pour quelques exceptions. La plus connue est celle des vaisseaux sanguins qui irriguent le cerveau, où les jonctions serrées très nombreuses sont à l'origine de la barrière hémato-encéphalique, obligeant toutes les molécules qui veulent y pénétrer (et a fortiori les micro-organismes éventuellement pathogènes, bien plus gros) à traverser les cellules endothéliales qui en assurent si nécessaire le transit, ou les refoulent.
Leur rôle ne se limite pas à une étanchéification entre des compartiments. Elles marquent aussi la frontière entre deux zones de la membrane plasmique des cellules épithéliales, la membrane apicale et la membrane basale, fonctionnellement très différentes. La présence de cette jonction bloque les protéines spécifiques de chaque zone et les empêche d'atteindre l'autre zone. Les jonctions serrées sont donc responsables du maintien de la polarité des cellules épithéliales.
Claudines

Les claudines sont des protéines transmembranaires que l'on trouve dans beaucoup d'organismes, et qui sont très semblables dans leur constitution, du ver nématode Caenorhabditis elegans jusqu'à l'homme (conservation). Elles ont une masse moléculaire de 20 à 27 kDa. Au niveau de la séquence d'ADN, cependant, la conservation n'est pas très forte.
Elles traversent la membrane cellulaire quatre fois, les extrémités[n 1] étant toutes deux dans le cytoplasme. Une claudine a deux domaines extracellulaires (hors de la cellule), formant une grande boucle et une petite. La première compte en moyenne 53 acides aminés, la seconde 24. L'extrémité N-terminale est en règle générale très courte (4 à 10 ac. am.), l'extrémité C-terminale est très variable (de 21 à 63). Dans la première boucle extracellulaire, on trouve un motif d'acides aminés, que l'on retrouve dans toutes les claudines, constitué de W…GLW…C…C[n 2]. On suppose qu'il se crée des ponts disulfures entre cystéines (C) d'une claudine ou de claudines voisines. Les domaines les mieux conservés sont les domaines transmembranaires, le plus variable est le C-terminal. Jusqu'à la claudine 12, toutes les claudines humaines possèdent sur l'extrémité C-terminale un « accepteur de domaine PDZ », qui se lie à une protéine ayant un « domaine PDZ » à l'intérieur de la cellule. Il a en outre été démontré que le C-terminal est nécessaire pour déterminer la localisation de la molécule dans la jonction serrée[1].
Jusqu'à présent, il a été identifié chez l'homme 24 types de claudines, désignées claudine 1, … claudine 24. Elles ne sont pas génétiquement regroupées, mais proviennent de divers chromosomes.
Histoire

Depuis que les jonctions serrées ont été décrites et que l'on a reconnu leur fonction dans les cellules, on a recherché les facteurs et les parties structurelles des jonctions serrées essentiels à leur obturation des intervalles intercellulaires. Au début des années 1990, le groupe japonais de Mikio Furuse et Shoichiro Tsukita, à l'université de Tokyo, a réussi à identifier la protéine transmembranaire occludine pour la première fois comme protéine de membrane intégralement liée aux jonctions serrées. Mais il a été établi que ce n'est pas l'occludine qui est responsable de la formation et du maintien de la barrière paracellulaire, car des cellules auxquelles manque l'occludine parviennent à construire des lignes de jonction serrée. Ce même groupe a découvert quelques années plus tard les deux premières protéines réellement responsables de la formation des jonctions serrées, et leur donna en 1998 le nom de « claudine », d'après le latin claudere (fermer)[2]. Certaines claudines avaient été précédemment décrites comme protéines dans d'autres contextes, mais leur fonction de composante d'obturation des jonctions serrées n'avait pas été reconnue à l'époque. À leur incorporation dans le groupe des claudines, elles ont été redésignées en tant que telles.
Par des recherches dirigées dans le génome de l'homme et de la souris, on a jusqu'à présent trouvé 24 protéines, qui, en raison de leur séquence, de leur structure et de leur expression, peuvent être rangées dans le groupe des claudines.
On a trouvé des claudines aussi chez d'autres espèces animales, par exemple chez tous les mammifères explorés jusqu'à présent, dans divers poissons (Takifugu rubripes, Poisson zèbre), chez des amphibiens (Xenopus laevis), et en 2003, de façon inattendue chez le nématode Caenorhabditis elegans et la mouche du vinaigre Drosophila melanogaster. Cette découverte était d'autant plus inattendue que ni C. elegans, ni D. melanogaster ne possèdent de jonctions serrées entre les cellules des épithéliums, mais des structures analogues, les jonctions septates.
Depuis, 500 travaux ont été publiés sur les claudines, leur expression, leur fonction et leur régulation. Comme elles sont les composantes essentielles des jonctions serrées, il serait du plus haut intérêt de pouvoir contrôler leur manipulation, par exemple pour franchir la barrière hémato-encéphalique, qui rend actuellement presque impossible le traitement chimiothérapique des tumeurs cérébrales.
Expression
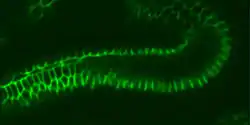
L'activité génétique des diverses claudines dans les divers tissus a été étudiée chez nombre d'organismes modèles : souris, C. elegans, poisson zèbre, drosophile, et en partie aussi chez l'homme. Chacune des 24 claudines connues a un modèle d'expression spécifique. Des recherches menées sur des claudines exprimées in vitro dans des cultures de cellules ont conduit à l'hypothèse que chaque claudine a ses propriétés individuelles par rapport à la sélectivité de charge, et probablement aussi à la sélectivité de dimension de la barrière à construire. La combinaison des diverses claudines exprimées dans un même épithélium détermine les propriétés de la barrière. Selon les nécessités de l'épithélium, diverses claudines sont exprimées, et ceci conduit à des barrières plus ou moins étanches[3]. En outre, il existe des claudines ubiquitaires, comme la claudine 1, et d'autres qui sont exprimées de façon très spécifique, soit dans l'espace, comme la claudine 16, qui n'est exprimée que dans la branche ascendante de l'anse de Henle, soit dans le temps, comme la claudine 6, qui chez la souris n’est exprimée que pendant l’embryogenèse.
Barrière paracellulaire
On ne sait pas encore comment les claudines interagissent entre elles et comment la structure des jonctions serrées est construite sur le plan moléculaire. Dans les expériences de culture cellulaire, on a pu montrer que les claudines peuvent entrer dans des liaisons aussi bien homophiles qu'hétérophiles spécifiques : des cellules qui peuvent exprimer la claudine 1 forment des jonctions serrées avec des cellules exprimant la claudine 3. De même, claudine 2 avec claudine 3. Cependant on n'obtient pas de jonction serrée entre cellules exprimant claudine 1 et claudine 2[4]. Un modèle propose que les claudines forment des pores aqueux, qui, selon leur type, laissent passer les ions et molécules jusqu'à une certaine charge et une certaine dimension (sélectivité de charge et de dimension). Ces propriétés sont déterminées par les radicaux chargés des acides aminés de la grande boucle extracellulaire, et ne dépendent pas du calcium. Des expériences de mutagenèse en culture cellulaire ont montré qu'un changement de charge de certains radicaux dans la première boucle extracellulaire conduit à un changement de la sélectivité de charge de la barrière[5],[6]. Ceci est mesuré par la TER (transepithelial resistance), ou résistance électrique transépithéliale.
Superfamille des claudines
La famille des claudines est rangée dans la superfamille PMP22/EMP/MP20/Claudines de la banque de données du Pfam[7] (pfam00822). Celle-ci contient en tout environ 450 protéines en provenance d'espèces différentes, qui ont toutes une structure voisine. Cependant, on a décrit pour certaines de ces protéines des fonctions totalement différentes de celles des claudines.
Maladies associées
Bien des maladies sont associées à une modification des claudines : par exemple, les claudines 3 et 4 sont des récepteurs de l'entérotoxine du Clostridium perfringens (CPE). Tout d'abord, elles n'ont pas été décrites comme claudines, mais comme Rvp1 (Rat ventral prostrate, ou prostration ventrale du rat), ultérieurement reclassée comme claudine 3, ou comme CPE-R (Clostridium perfringens Enterotoxin Receptor, ou récepteur de CPE) ultérieurement reclassée comme claudine 4. La liaison du CPE à la claudine 3 ou 4 conduit en dix à vingt minutes à la lyse de la cellule exprimant la claudine, et par là à un endommagement de l’épithélium intestinal, qui s'exprime par une forte diarrhée.
Diverses maladies de l'homme sont attribuables à des mutations sur les gènes des claudines. Par exemple, les mutations de la claudine 16, qui s'appelle aussi paracelline, conduit à une augmentation de l'évacuation du calcium dans l'urine (hypercalciurie) et une chute du contenu du sang en magnésium (hypomagnésiémie).
La claudine 14, chez les vertébrés, est exprimée dans le foie, le rein, le pancréas et l'oreille interne. Chez les souris, on a pu montrer que l'expression de la claudine 14 dans l’oreille interne ne commence qu'après la naissance. Dans deux familles vivant au Pakistan, on a identifié des mutations qui provoquent soit un décalage de la lecture du gène, soit l'introduction d'un codon-stop. Cette mutation conduit de façon récessive à la surdité, tandis que les fonctions rénales et hépatiques paraissent normales. Les mutants correspondants chez la souris n'ont pas de défaut des fonctions rénales ou hépatiques. Le phénotype analysé de plus près chez la souris mutante a montré que les cellules ciliées de l'oreille interne dégénèrent quand la claudine 14 manque dans les jonctions serrées de l'oreille interne, ce qui conduit à la perte de l’audition. Les rangées de jonctions serrées entre les cellules ciliées externes et l’organe de Corti sont pourtant présentes, et la polarité cellulaire est préservée. La dégénérescence des cellules ciliées découle probablement d'une concentration trop élevée en potassium pendant le développement initial de l’audition[8].
La claudine 11, qui était d'abord désignée comme OSP (Oligodendrocyte-specific Protein) est exprimée principalement dans la myéline du système nerveux central et dans les testicules. Les souris mutantes présentent un ralentissement de l’influx nerveux, et un affaiblissement des membres postérieurs. Les mâles sont stériles, mais survivent. L'observation au microscope électronique des cryosections montrent que l'on ne trouve pas de jonctions serrées dans les myélines du système nerveux central, ni dans les cellules de Sertoli[9]. Chez ces mutants, la barrière hémato-spermatique est déficiente. La claudine 11 interagit avec l’OAP (OSP-Claudin 11 Associated Protein) et avec l'intégrine bêta 1 pour former un complexe qui joue un rôle dans l'adhésion des cellules et la signalisation des intégrines.
La claudine 19 s'exprime dans les cellules de Schwann du système nerveux périphérique où elle forme des structures analogues aux jonctions serrées. Les souris présentant une délétion dans le domaine génétique de la claudine 19, n'ont pas ces structures, et présentent des troubles de la conduction de l’influx nerveux, ce qui nuit au bon fonctionnement de l’appareil locomoteur.
Les souris auxquelles la claudine 1 manque meurent de déshydratation quelques heures après la naissance. Une mutation dans le gène de la claudine 1 chez l'homme conduit à de graves malformations de la peau. Les souris auxquelles la claudine 5 manque ont un phénotype spécial : leur barrière hémato-encéphalique est perméable aux petites molécules. Une surexpression de la claudine 6 conduit à un trouble fonctionnel de l’épiderme.
Ces exemples montrent que les claudines exercent des fonctions décisives pour le bon fonctionnement de la barrière paracellulaire de divers épithéliums, et peuvent par là être réparties en divers groupes : les claudines ménagères, qui sont exprimées de façon largement ubiquitaire, et qui assument des fonctions de base pour la formation des bandes de jonctions serrées, et les claudines spécialisées, qui ne sont exprimées que dans certains tissus, ou qui ne jouent pas un rôle essentiel dans tous les tissus où elles sont exprimées.
Voir aussi
Bibliographie
- (en) Christina M. Van Itallie et James M. Anderson, « Claudins and Epithelial Paracellular Transport. », Annual Review of Physiology, vol. 68, , p. 403-429 (ISSN 0066-4278, lire en ligne)
- (en) Julia E. Rasmussen, Claudins and regulation of the paracellular transport system : Thèse de M.S., Chapel Hill, The University of North Carolina at Chapel Hill, (ISBN 978-0-542-54616-7)
- (en) Christina M. Van Itallie et James M. Anderson, « Physiology and Function of the Tight Junction », Cold Spring Harbor Perspect Biol., vol. 1, no 2, (PMID 20066090, DOI 10.1101/cshperspect.a002584, lire en ligne)
Notes et références
Références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Claudin » (voir la liste des auteurs).
- (en) C. Ruffer et V. Gerke, « The C-terminal cytoplasmic tail of claudins 1 and 5 but not its PDZ-binding motif is required for apical localization at epithelial and endothelial tight junctions », European journal of cell biology (EJCB), vol. 83, no 4, , p. 135-144 (ISSN 0070-2463, PMID 15260435, résumé)
- (en) M. Furuse, K. Fujita, T. Hiiragi, K. Fujimoto et S. Tsukita, « Claudin-1 and -2: novel integral membrane proteins localizing at tight junctions with no sequence similarity to occludin. », The journal of cell biology (JCB)., vol. 29, no 7, , p. 1539-1550 (ISSN 0021-9525, PMID 9647647, lire en ligne)
- (en) M. Furuse et S. Tsukita, « Claudins in occluding junctions of humans and flies. », Trends in Cell Biology., vol. 16, no 4, , p. 181-188 (ISSN 0962-8924, PMID 16537104, résumé)
- Eveline E. Schneeberger et Robert D. Lynch, « The tight junction: a multifunctional complex », American Journal of Physiology-Cell Physiology, vol. 286, no 6, , C1213–C1228 (ISSN 0363-6143, DOI 10.1152/ajpcell.00558.2003, lire en ligne, consulté le )
- (en) O.R. Colegio, C. Van Itallie, C. Rahner et J.M. Anderson, « Claudin extracellular domains determine paracellular charge selectivity and resistance but not tight junction fibril architecture. », American journal of physiology., vol. 284, no 6, , C1346-1354 (ISSN 0363-6143, PMID 12700140, lire en ligne)
- (en) E.E. Schneeberger, « Claudins form ion-selective channels in the paracellular pathway. », American journal of physiology., vol. 284, no 6, , C1346-1354 (ISSN 0363-6143, PMID 12734103, lire en ligne)
- (en) « Banque de données des protéines Pfam », Institut Sanger de Cambridge (Angleterre) (consulté le )
- (en) T Ben-Yosef et al., « Claudin 14 knockout mice, a model for autosomal recessive deafness DFNB29, are deaf due to cochlear hair cell degeneration. », Human molecular genetics., vol. 12, no 16, , p. 2049-2061 (ISSN 0964-6906, PMID 12913076, lire en ligne)
- (en) A. Gow, C.M. Southwood, J.S. Li, M. Pariali, G.P. Riordan, S.E. Brodie, J. Danias, J.M. Bronstein, B. Kachar et R.A. Lazzarini, « CNS myelin and sertoli cell tight junction strands are absent in Osp/claudin-11 null mice. », Cell, vol. 99, no 6, , p. 649-659 (ISSN 0092-8674, PMID 10612400, résumé)
Notes
- Voir les notions sur la structure des protéines
- Voir dans l'article sur les acides aminés la table de leurs abréviations et de leurs principales propriétés
- Portail de la biologie cellulaire et moléculaire
- Portail de la biochimie
- Portail de la médecine