Métabisulfite de potassium
Le métabisulfite de potassium, ou pyrosulfite de potassium, est un composé chimique de formule K2S2O5. Il se présente sous la forme d'une poudre blanche cristallisée dans le système monoclinique, soluble dans l'eau, à faible odeur de dioxyde de soufre SO2. Il est constitué de cations potassium K+ et d'anions disulfite S2O52−, et est très semblable au métabisulfite de sodium Na2S2O5, avec lequel il est parfois utilisé de façon interchangeable, mais avec une préférence pour le premier dans la mesure où il n'apporte pas de sodium Na+ au régime alimentaire.
| Métabisulfite de potassium | |
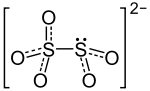 Composition du métabisulfite de potassium |
|
| Identification | |
|---|---|
| Synonymes |
pyrosulfite de potassium, |
| No CAS | |
| No ECHA | 100.037.072 |
| No CE | 240-795-3 |
| No RTECS | TT4920000 |
| PubChem | 28019 |
| No E | E224 |
| SMILES | |
| InChI | |
| Apparence | poudre cristallisée blanche à faible odeur de dioxyde de soufre |
| Propriétés chimiques | |
| Formule | K2O5S2 |
| Masse molaire[1] | 222,324 ± 0,012 g/mol K 35,17 %, O 35,98 %, S 28,85 %, |
| Propriétés physiques | |
| T° fusion | décomposition au-delà de 150 °C[2] |
| Solubilité | 450 g·l-1[2] à 20 °C |
| Masse volumique | 2,34 g·cm-3 |
| Précautions | |
| SGH[2] | |
  Danger |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Le métabisulfite de potassium se décompose par chauffage entre 150 et 190 °C en libérant du dioxyde de soufre SO2 et en laissant un résidu solide d'oxyde de potassium K2O :
Usages
Le métabisulfite de potassium est employé essentiellement comme additif alimentaire antioxydant et comme stérilisateur sous le numéro E224.
La mention « contient des sulfites » est obligatoire lorsque la concentration en SO32− dépasse le 10 mg/kg ou par litre de produit fini[3].
Son utilisation est cependant réglementée, et il est susceptible de provoquer des réactions allergiques sévères chez les sujets sensibles.
Vins
Le métabisulfite de potassium est un additif courant du vin, au sein duquel il forme du dioxyde de soufre (SO2). Ceci, à la fois, ralentit la prolifération de micro-organismes et agit comme un puissant antioxydant, protégeant à la fois la couleur et les saveurs du vin. La dose courante avant fermentation est d'environ 75 ppm de SO2, puis 150 ppm de SO2 lors de la mise en bouteille.
Bières
Le métabisulfite de potassium peut être utilisé dans l'industrie de la bière pour réduire la prolifération de bactéries et champignons. Cet usage est appelé « la stabilisation ». Il est également utilisé pour neutraliser la chloramine qui a été ajoutée à l'eau du robinet comme désinfectant. En revanche, il n'entre pas en application lors du brassage de la bière, car le moût est presque toujours bouilli, ce qui tue la plupart des micro-organismes.
Autres applications
- agent de conservation dans le jus de citron ;
- agent de teinture et d'impression sur le coton dans l'industrie textile ;
- alternative au sulfite de sodium dans la prospection aurifère pour précipiter l'or ;
- en photographie, composante de certaines solutions utilisées dans la fixation ;
- agent blanchissant dans la production de la crème de noix de coco ;
- agent de conservation de certains cornichons ;
- dans les échantillons de métal à base de fer de gravure de teinte pour l'analyse micro-structurelle.
Risques
Le métabisulfite de potassium provoque une irritation de la peau, des yeux, et peut provoquer une irritation respiratoire. Par conséquent, il doit être manipulé avec une protection individuelle, tels que des gants, blouse, masque et lunettes.
En présence d'acides, il réagit en dégageant des gaz toxiques.
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Dipotassium disulfite » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 9 mars 2013 (JavaScript nécessaire)
- Test E224, métabisulfite de potassium par l'UFC Que Choisir.
- Portail de la chimie