Liaison à trois centres et quatre électrons
La liaison à trois centres et quatre électrons, abrégée en liaison 3c-4e, est un modèle employé pour décrire les liaisons dans certaines molécules hypervalentes telles que les interhalogènes de formules générales XY3 et XY5, le tétrafluorure de soufre SF4, les fluorures de xénon XeFn et l'ion bifluorure HF2−[1],[2]. Elle est également connue comme modèle à trois centres de Pimentel-Rundle à la suite des travaux publiés par George C. Pimentel en 1951[3] à partir des idées développées plus tôt par Robert E. Rundle sur les liaisons déficitaires en électrons[4],[5]. Une version étendue de ce modèle permet de décrire l'ensemble des molécules hypervalentes telles que le pentafluorure de phosphore PF5 et l'hexafluorure de soufre SF6 ainsi que les liaisons π multi-centres comme celles de l'ozone O3 et du trioxyde de soufre SO3.
Il existe également des molécules telles que le diborane B2H6 et le dialane Al2H6 caractérisées par des liaisons à 3 centres et 2 électrons (3c-2e).
Introduction avec le difluorure de xénon
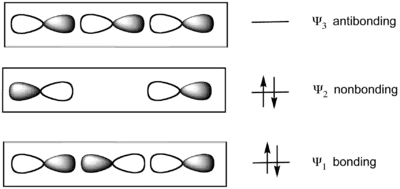
Le modèle considère la liaison de trois atomes colinéaires. Dans le difluorure de xénon XeF2, le groupe F–Xe–F est décrit par un ensemble de trois orbitales moléculaires dérivées des orbitales atomiques p colinéaires des trois atomes. Dans ce modèle, les liaisons Xe–F résultent de la combinaison :
- d'une orbitale atomique p occupée de l'atome de xénon central ;
- de deux orbitales atomiques p semi-occupées sur chacun des deux atomes de fluor latéraux.
D'où :
- une orbitale moléculaire liante Ψ1 occupée ;
- une orbitale moléculaire non liante Ψ2 occupée ;
- une orbitale moléculaire antiliante Ψ3 vacante.
Les deux orbitales moléculaires d'énergie la plus basse sont occupées deux fois. L'orbitale moléculaire haute occupée se trouve sur les deux atomes latéraux, qui sont fortement électronégatifs dans les molécules hypervalentes. D'après ce modèle, les molécules de tétrafluorure de soufre SF4 et de pentafluorure de phosphore PF5 sont décrites avec une liaison à trois centres et quatre électrons ainsi que, respectivement, deux et trois liaisons conventionnelles ; dans la molécule d'hexafluorure de soufre SF6 ainsi que dans celles des fluorures de xénon XeF2, XeF4 et XeF6, toutes les liaisons sont décrites comme à trois centres et quatre électrons.
Les liaisons dans la molécule XeF2 peuvent également être représentées qualitativement avec des formules de Lewis en résonance :
- F–Xe+ −F ⟷ F− +Xe–F.
Cette représentation respecte la règle de l'octet, avec des liaisons d'ordre 1⁄2 et avec accroissement de la densité électronique autour des deux atomes de fluor latéraux : ceci est cohérent avec les diagrammes des orbitales moléculaires présentés plus haut.
Illustration avec l'anion triiodure

Orbitales moléculaires
De la même manière, les orbitales moléculaires σ de l'anion triiodure I3− peuvent être modélisées en considérant les combinaisons en phase ou en opposition de phase des orbitales p de l'atome central et des atomes périphériques colinéaires[6]. Cet exercice produit le diagramme ci-contre. Les quatre électrons occupent les deux orbitales moléculaires de plus basse énergie, Ψ1 liante délocalisée le long des trois atomes et Ψ2 non liante localisée autour des atomes périphériques, tandis que l'orbitale moléculaire de plus haute énergie Ψ3, antiliante, demeure vacante. Cette représentation évite de considérer des liaisons hypervalentes au niveau de l'atome central car l'orbitale liante est constituée deux liaions à deux centres et un électron qui ne violent pas la règle de l'octet tandis que les deux autres électrons occupent l'orbitale non liante.
Analyse NBO
L'analyse NBO (en) de la liaison 3c-4e de l'anion triiodure I3− la considère comme la combinaison des orbitales moléculaires σ du diiode I2 et d'un doublet non liant d'un anion iodure I−. Ce dernier agit comme un donneur de deux électrons tandis que l'orbitale σ* antiliante du diiode agit comme un accepteur de deux électrons[6]. La combinaison en phase et en opposition de phase des orbitales donneuses et acceptrices d'électrons conduit au diagramme ci-contre. L'énergie de l'orbitale haute occupée Ψ2 baisse à la suite de la combinaison du doublet non liant donneur avec l'orbitale antiliante σ* acceptrice. Le diagramme ci-contre considère que le donneur se trouve du côté droit, mais un diagramme équivalent peut être construit en considérant que le donneur se trouve sur l'atome de gauche.
Résonance
Ce mode de liaison est illustré simplement par les deux structures en résonance suivantes, dans lesquelles « — » représente une liaison simple et « ··· » représente une liaison d'ordre nul indiquant simplement la connectivité :
Dans cette résonance, chacune des liaisons a un ordre 1⁄2, qu'on retrouve à la fois à partir de la théorie de l'orbitale moléculaire et de l'analyse NBO (en).
Électronégativité inversée

Des analyses théoriques suggèrent la possibilité d'un type différent d'interactions donneur-accepteur dans les espèces triatomiques présentant une électronégativité inversée[7], c'est-à-dire dans lesquelles l'atome central est plus électronégatif que les atomes périphériques. Des molécules théoriques telles que le difluorure de néon NeF2 et le dilithiure de béryllium BeLi2 sont des exemples de telles espèces à électronégativité inversée, l'électronégativité du néon sur l'échelle d'Allen étant 4,787 lorsque celle du fluor vaut 4,193[8],[9]. Dans cette configuration inhabituelle, le doublet non liant donneur se trouve sur l'atome central tandis que l'orbitale antiliante acceptrice résulte de la combinaison des orbitales p des atomes périphériques. Cette situation est représentée par le diagramme ci-contre relatif au difluorure de néon NeF2.
Notes et références
- (en) N. N. Greenwood et A. Ershshaw, Chemistry of the Elements, Elsevier Butterworth-Heinemann, 2e édition, Oxford, 2005, p. 275-306. (ISBN 0-7506-3365-4).
- (en) Frank Weinhold et Clark R. Landis, Valency and Bonding: A Natural Bond Orbital Donor-Acceptor Perspective, Cambridge University Press, 2005, p. 275-306. (ISBN 978-0521831284)
- (en) George C. Pimentel, « The Bonding of Trihalide and Bifluoride Ions by the Molecular Orbital Method », The Journal of Chemical Physics, vol. 19, no 4, , p. 446-448 (DOI 10.1063/1.1748245, Bibcode 1951JChPh..19..446P, lire en ligne)
- (en) R. E. Rundle, « Electron Deficient Compounds. II. Relative Energies of "Half‐Bonds" », The Journal of Chemical Physics, vol. 17, no 8, , p. 671-675 (DOI 10.1063/1.1747367, Bibcode 1949JChPh..17..671R, lire en ligne)
- (en) R. E. Rundle, « Electron Deficient Compounds », The Journal of Physical Chemistry, vol. 61, no 1, , p. 45-50 (DOI 10.1021/j150547a010, lire en ligne)
- (en) Gregory A. Landrum, Norman Goldberg et Roald Hoffmann, « Bonding in the trihalides (X3−), mixed trihalides (X2Y−) and hydrogen bihalides (X2H−). The connection between hypervalent, electron-rich three-center, donor–acceptor and strong hydrogen bonding », Journal of the Chemical Society, Dalton Transactions, no 19, , p. 3605-3613 (DOI 10.1039/A703736H, lire en ligne)
- (en) C. R. Landis et F. Weinhold, « 3c/4e σ-Type Long-Bonding: A Novel Transitional Motif toward the Metallic Delocalization Limit », Inorganic Chemistry, vol. 52, no 9, , p. 5154-5166 (PMID 23597392, DOI 10.1021/ic4000395, lire en ligne)
- (en) Leland C. Allen, « Electronegativity is the average one-electron energy of the valence-shell electrons in ground-state free atoms », Journal of the American Chemical Society, vol. 111, no 25, , p. 9003-9014 (DOI 10.1021/ja00207a003, lire en ligne)
- (en) Joseph B. Mann, Terry L. Meek et Leland C. Allen, « Configuration Energies of the Main Group Elements », Journal of the American Chemical Society, vol. 122, no 12, , p. 2780-2783 (DOI 10.1021/ja992866e, lire en ligne)
