Liaison triple
En chimie, une liaison triple est une liaison chimique entre deux atomes impliquant six électrons de valence au lieu de deux dans une liaison covalente simple. On trouve notamment parmi les composés possédant une liaison triple les alcynes (triple liaison C≡C), les nitriles et les isonitriles (triple liaison C≡N). Certaines molécules diatomiques comme le diazote N2 ou le monoxyde de carbone CO contiennent aussi des liaisons triples. En représentation topologique, une liaison triple est représentée par trois lignes parallèles (≡) placées entre les deux atomes liés. En typographie, on utilise l'opérateur identité[1],[2],[3].
Les liaisons triples sont plus fortes que les liaisons simples et les liaisons doubles, et sont aussi plus courtes. Leur ordre de liaison est égal à 3.
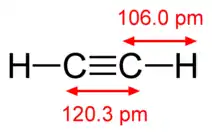
| 
| 
| 
|
| Acétylène H−C≡C−H | Cyanogène N≡C−C≡N | Monoxyde de carbone C≡O | Diazote N≡N |
Liaison
Ce type de liaison peut être expliqué en termes d'hybridation d'orbitales. Dans le cas de l'acétylène, chaque atome de carbone a deux orbitales sp et deux orbitales p. Les deux orbitales sp sont linéaires (angle de 180°) et occupent l'axe des abscisses (x en coordonnées cartésiennes). Les orbitales p sont perpendiculaires, selon les axes y et z. Quand les deux atomes de carbone s'approchent, un recouvrement des orbitales sp-sp forme une liaison σ. En même temps, les orbitales pz approchent et se recouvrent latéralement pour former une liaison π pz-pz, et les orbitales py font de même formant une liaison π py-py. Le résultat est la formation d'une liaison σ et de deux liaisons π.
Dans les liaisons banane, la triple liaison est formée par le recouvrement des trois lobes sp3, donc sans le recours à une liaison π[4].
On trouve des liaisons triples entre atomes d'éléments plus lourds que le carbone, notamment entre atomes de métaux de transition. L'hexa(tert-butoxy)ditungstène(III) (((CH3)3CO)3W)2 et l'hexa(tert-butoxy)dimolybdène(III) (((CH3)3CO)3Mo)2 en sont des exemples bien connus. La longueur de la liaison M≡M est de l'ordre de 233 pm[5]. Le composé au tungstène a notamment attiré l'attention du fait de ses réactions avec les alcynes donnant des triples liaisons carbone≡métal de formule générale RC≡W(OBut)3[6].
Notes et références
- (en) Jerry March, Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 3e éd., Wiley, 1985. (ISBN 0-471-85472-7)
- (en) John McMurry, Organic Chemistry, 2e éd., Brooks/Cole, 2010. (ISBN 978-0495391470)
- (en) Pekka Pyykkö, Sebastian Riedel et Michael Patzschke, « Triple-Bond Covalent Radii », Chemistry, vol. 11, no 12, , p. 3511-3520 (PMID 15832398, DOI 10.1002/chem.200401299, lire en ligne)
- (en) Francis A. Carey et Richard J. Sundberg, Advanced Organic Chemistry: Part A: Structure and Mechanisms, Springer, 2007. (ISBN 978-0387448978)
- (en) Malcolm H. Chisholm, Judith C. Gallucci et Carl B. Hollandsworth, « Crystal and molecular structure of W2(OBut)6 and electronic structure calculations on various conformers of W2(OMe)6 », Polyhedron, vol. 25, no 4, , p. 827-833 (DOI 10.1016/j.poly.2005.07.010, lire en ligne)
- (en) Mark L. Listemann et Richard R. Schrock, « Multiple metal carbon bonds. 35. A general route to tri-tert-butoxytungsten alkylidyne complexes. Scission of acetylenes by ditungsten hexa-tert-butoxide », Organometallics, vol. 4, no 1, , p. 74-83 (DOI 10.1021/om00120a014, lire en ligne)
- Portail de la chimie
3)6.svg.png.webp)