Lorcasérine
La lorcasérine, vendue sous le nom de Belviq aux États-Unis, est un médicament anorexigène par voie orale. Ce traitement n'a pas d'autorisation de mise sur le marché dans l'Union Européenne[2].
| Lorcasérine | ||
| ||
 | ||
| Identification | ||
|---|---|---|
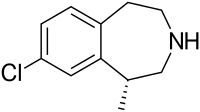
| Nom UICPA | (1R)-8-chloro-1-méthyl-2,3,4,5-tétrahydro-1H-3-benzazépine | |
| No CAS | (chlorhydrate) |
|
| No ECHA | 100.237.138 | |
| Code ATC | ||
| PubChem | 11658860 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C11H14ClN [Isomères] |
|
| Masse molaire[1] | 195,689 ± 0,012 g/mol C 67,51 %, H 7,21 %, Cl 18,12 %, N 7,16 %, |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
Mode d'action
| lorcasérine | |
| Informations générales | |
|---|---|
| Princeps |
|
| Laboratoire | Eisai |
| Identification | |
| No CAS | |
| No ECHA | 100.237.138 |
| Code ATC | A08AA11 |
| DrugBank | 04871 |
Il s'agit d'un agoniste des récepteurs sérotoninergiques de type 5HT-2c, sans action sur le récepteur 5HT-2b, ce dernier étant responsable de certains effets secondaires comme l'hypertension artérielle pulmonaire[3]. Elle se distingue ainsi de la fenfluramine. Elle agit par une baisse des apports alimentaires, sans augmentation de la dépense énergétique[4].
Pharmacologie
La molécule est métabolisée par le foie, ses métabolites étant excrétés par le rein[5].
Efficacité
À un an, la moitié des patients sous lorcasérine ont perdu plus de 5 % de leur poids[6], et ce, de manière dose dépendante[7]. Elle permet l'amélioration des paramètres glycémiques chez le diabétique de type 2[8] et diminue le risque de survenue d'un diabète[9]. Le taux d'abandon du traitement reste notable et il n'existe aucune donnée sur le risque cardio-vasculaire[5].
Effets secondaires
Les effets secondaires les plus fréquents sont les maux de tête, les douleurs de dos, les pharyngites et les nausées[8].
Il ne semble pas exister d'atteinte cardiaque, en particulier valvulaire[10] (contrairement à la fenfluramine et au benfluorex).
Il a un risque cancérogène chez les animaux mais qui n'a pas été mis en évidence chez l'être humain[11].
Le 13 février 2020 l'agence américaine des médicaments (FDA) a demandé au laboratoire fabricant le BELVIQ et le BELVIQ XR (forme à libération retardée) de renoncer volontairement à la vente sur le marché des États-Unis, de ces deux spécialités pharmaceutiques. Cette demande était fondée sur le résultat d'une étude tendant à prouver que les personnes prenant ces médicaments présentaient un risque augmenté d'apparition de cancer. Il s'agissait essentiellement de cancer du pancréas et du colon. Le laboratoire Eisai s'est soumis à la demande de la FDA. L'étude CAMELLIA-TIMI 61 [12]. qui s'est déroulée de 2014 à 2018 visaient essentiellement à mettre en évidence des effets indésirables de type cardiovasculaire (c'est cet effet indésirable qui avait conduit au retrait de sibutramine aux États-Unis et de Médiator en France.) Cette étude qui a inclus 12 000 malades ne visait pas la pathologie cancéreuse et l'augmentation de l'apparition de certains cancers a été une observation accidentelle. Toutefois la conception de l'étude ne permet pas d'affirmer statistiquement cette augmentation. Cependant la FDA a considéré que le rapport bénéfice risque n'était pas en faveur du traitement de l'obésité par lorcaserine [13] .
Place dans la stratégie thérapeutique
Aucun médicament en 2014 n'a une balance bénéfice risques favorable dans cette indication[2].Le traitement de l'obésité repose sur des mesures diététiques et l'exercice physique.
Selon la revue Prescrire, ce traitement n'a aucun avantage évident mais a des inconvénients possibles ou certains[2].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- La revue Prescrire, février 2014, p. 99
- (en) Thomsen WJ, Grottick AJ, Menzaghi F et al. « Lorcaserin, a novel selective human 5-hydroxytryptamine2C agonist: in vitro and in vivo pharmacological characterization » J Pharmacol Exp Ther, 2008;325:577–587
- (en) Martin CK, Redman LM, Zhang J et al. « Lorcaserin, a 5-HT(2C) receptor agonist, reduces body weight by decreasing energy intake without influencing energy expenditure » J Clin Endocrinol Metab, 2010;96:837–845
- (en) Rueda-Clausen CF, Padwal RS, « Pharmacotherapy for weight loss » BMJ, 2014;348:g3526
- (en) Smith SR, Weissman NJ, Anderson CM et al. « Multicenter, placebo-controlled trial of lorcaserin for weight management » N Engl J Med, 2010;363:245–256
- (en) Fidler MC, Sanchez M, Raether B et al. « A one-year randomized trial of lorcaserin for weight loss in obese and overweight adults: the BLOSSOM trial » J Clin Endocrinol Metab, 2011;96:3067–3077
- (en) O’Neil PM, SmithSR, Weissman NJ et al. « Randomized placebo-controlled clinical trial of lorcaserin for weight loss in type 2 diabetes mellitus: the BLOOM-DM study » Obesity (Silver Spring), 2012;20:1426–1436
- Bohula EA, Scirica BM, Inzucchi SE et al. Effect of lorcaserin on prevention and remission of type 2 diabetes in overweight and obese patients (CAMELLIA-TIMI 61): a randomised, placebo-controlled trial, Lancet, 2018;392:2269-2279
- (en) Meltzer H, Roth BL, « Lorcaserin and pimavanserin: emerging selectivity of serotonin receptor subtype–targeted drugs » J Clin Invest, 2013;123:4986–4991
- (en) Colman E, Golden J, Roberts M, Egan A, Weaver J, Rosebraugh C, « The FDA’s assessment of two drugs for chronic weight management » N Engl J Med, 2012;367:1577-9
- Design and rationale for the Cardiovascular and Metabolic Effects of Lorcaserin in Overweight and Obese Patients-Thrombolysis in Myocardial Infarction 61 (CAMELLIA-TIMI 61) trial Am Heart J. 2018 Aug;202:39-48. doi: 10.1016/j.ahj.2018.03.012. Epub 2018 Mar 29
- Cancer Risk Associated with Lorcaserin — The FDA’s Review of the CAMELLIA-TIMI 61 Trial N Engl J Med 2020; 383:1000-1002 DOI: 10.1056/NEJMp2003873
- Portail de la médecine
- Portail de la pharmacie
- Portail de la chimie