Méthylisothiazolinone
La méthylisothiazolinone, MIT ou MI, est un puissant biocide et conservateur du groupe des isothiazolinones, utilisée dans les produits de soins et de nombreux autres produits (peintures notamment[2]) depuis 2005[3]. C'est un produit allergène, source d'eczéma allergique chronique (y compris pour les produits rinçables, et avec de nombreuses rechutes[4]).
Pour les articles homonymes, voir MIT (homonymie) et MI.
| Méthylisothiazolinone | |
| |
| Identification | |
|---|---|
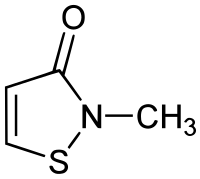
| Nom UICPA | 2-méthylisothiazol-3(2H)-one |
| No CAS | |
| No ECHA | 100.018.399 |
| PubChem | 39800 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C4H5NOS [Isomères] |
| Masse molaire[1] | 115,154 ± 0,009 g/mol C 41,72 %, H 4,38 %, N 12,16 %, O 13,89 %, S 27,85 %, |
| Propriétés physiques | |
| T° fusion | 44,2 à 48,3 °C[réf. souhaitée] |
| T° ébullition | décomp. à partir de 236 °C[réf. souhaitée] |
| Masse volumique | 1,39 g cm−3 (20 °C)[réf. souhaitée] |
| Pression de vapeur saturante | à 20 °C : 0,4-0,99 Pa ; à 25 °C : 0,7-1,6 Pa[réf. souhaitée] |
| Unités du SI et CNTP, sauf indication contraire. | |
À la suite des scandales autour des parabènes, son usage s'est, en quelques années généralisé dans les produits cosmétiques et en 2010-2016 il est à l'origine d'« une épidémie sans précédent d'allergie de contact », dont en Europe[5], avec de possibles allergies croisées à l'octylisothiazolinone (OIT) et au benzisothiazolinone (BIT).
D'après des expériences sur le modèle animal (souris) les personnes sensibilisées au méthylisothiazolinone (MI) peuvent aussi réagir à l'OIT et au BIT si elles ont été exposées à une concentration suffisante de MI[6].
Applications
La méthylisothiazolinone et les autres dérivés des biocides isothiazolinone sont utilisés pour contrôler la croissance microbienne dans des solutions contenant de l'eau[7]. Deux des biocides isothiazolinone les plus largement utilisés sont la 5-chloro-2-méthyl-4-isothiazolin-3-one (chlorométhylisothiazolinone ou CMIT) et la 2-méthyl-4-isothiazolin-3-one (méthylisothiazolinone ou MIT), qui sont les ingrédients actifs dans un mélange 3:1 (CMIT:MIT) vendu commercialement sous le nom de Kathon. Les produits Kathon sont vendus aux fabricants sous forme de solution concentrée contenant entre 10 et 15 % de CMIT/MIT.
Pour application, l'utilisation recommandée est entre 6 et 75 ppm d'isothiazolones actives. Les applications biocides couvrent un spectre allant du stockage d'eau industriel aux unités de refroidissement, à des processus aussi variés que l'exploitation minière, la fabrication de papier, le travail des métaux fluides et la production d'énergie. De plus, une isothiazolinone, Sea-Nine 211 (4,5-dichloro-2-n-octyl-4-isothiazolino-3-one, DCOI), a rapidement remplacé le tributylétain comme agent antifouling dans la peinture des bateaux. Une étude récente a révélé la présence de DCOI à la fois dans les eaux portuaires et les échantillons de sédiments d'Osaka, au Japon, spécialement dans certaines zones[8]. Au niveau environnemental, les niveaux de DCOI considérés dans les marinas sont à présent considérés comme une question pour diverses espèces d'invertébrés marins (en)[9]. Les isothiazolinones sont aussi extrêmement toxiques pour les poissons[10]. La large utilisation d'isothiazolinones dans le domaine industriel a conduit à un très grand nombre de cas d'exposition humaine préoccupants, parfois dans des proportions épidémiques[11]. Cela survient d'abord, mais pas exclusivement, quand les travailleurs sont exposés à des solutions stockées au cours du processus de dilution, conduisant à des brûlures chimiques, des dermatites de contact, et des réactions allergiques[4]. Les expositions par inhalation sont aussi très courantes[12].
Écotoxicologie
Alors que l'agriculture était autrefois et depuis des décennies la principale source depuis longtemps de biocide dans l'environnement, la lixiviation des peintures et enduits de façades des bâtiments[2] et le rinçage (douches, bains, baignades) de cosmétiques et de produits de soins personnels et de nettoyage sont devenus de nouvelles sources préoccupantes de contamination de l'eau et de l’environnement[13].
La Méthylisothiazolinone est depuis les années 2010 très présente dans les peintures[2] et produits de soins. Les lixiviats et produits de rinçage en contenant sont de plus en plus retrouvés dans les eaux d'égouts et/ou de baignade, et comme plusieurs autres biocides elle se montre génotoxique pour certains animaux aquatiques (tests fait sur la truite)[14].
Chez la souris une réaction inflammatoire/immunitaire apparait en trois jours et une sensibilisation est facile à induire[6].
Un autre effet préoccupant, démontré par une publication de 2017 chez le planaire (5 espèces différentes utilisés dans ce cas comme espèce modèle) est que outre une perte d'intégrité épithéliale et de fonction neuromusculaire chez les planaires non lésés, cette molécule a inhibé la cicatrisation et de la régénération de planaires expérimentalement lésés[15]. Lors de cette étude des antioxydants se sont révélés être des antidotes des effets (chez le planaire). La même équipe avait précédemment montré que la Méthylisothiazolinone inhibait également la cicatrisation et la régénération de la queue de la jeune grenouille Xenopus laevis.
Une étude publiée en 2018 a apporté des données nouvelles concluant à une toxicité faible de ce produit pour la cellule (sur la base de tests in vitro sur des cultures de cellules de foie de truite arc-en-ciel (RTL-W1) et des cellules ovariennes de hamsters femelles (CHO-9), mais note que sur la base des données publiées, les valeurs de PNEC sont beaucoup plus élevées pour l'IM (0,5 μg/l) que pour la Terbutryne ou TB (0,003 μg/l) ou l'octhilinone ou OI (0,05 μg/l)[13]. Cette étude laisse penser que les risques environnementaux et écotoxicologiques posés par ce produit pourraient avoir été sous-estimés[16].
Santé humaine
De nombreuses études ont montré que la MIT est allergénique (une exposition prolongée induit un risque plus élevée de dermatite allergique de contact[17], avec parfois une réactivité croisée (avec la Pemphigoïde bulleuse pouvant conduire à l'hospitalisation[18]) et qui semble cytotoxique (toxique pour les cellules)[19] et un travail récent (2017) a montré :
- qu'il existe une grande différence de passage percutané (dans la peau) selon qu'il y a ou non rinçage du produit après qu'il a été posé sur la peau[20] ;
- que les estimations d'exposition utilisées pour des utilisations répétées de produits par jour étaient trop prudentes[20].
En France, les résultats d’une étude du REVIDAL-GERDA (Réseau de Vigilance en Dermatologie Allergologie rattaché au Groupe d’Étude et de Recherche en Dermatologie Allergologie) ont montré qu’entre 2010 et 2012 la proportion de tests positifs à la méthylisothiazolinone a plus que triplé. Cette augmentation résulte probablement du remplacement de certains produits conservateurs (parabène, méthanal, méthyldibromoglutaronitrile (en)) par ce produit[21].
À la suite des différentes publications scientifiques européennes, la MI a été déclarée « allergène de l’année 2013 » aux États-Unis et va être testée en routine dans la batterie d’allergènes standard nord-américaine[22] et en 2013 la situation épidémiologique avait empiré.
Définitions
La dermite de contact est une atteinte locale de la peau causée par le contact de celle-ci avec une substance étrangère. Il existe deux types de dermite de contact : la dermite de contact irritative et la dermite de contact allergique.
- La dermite de contact irritative, plus fréquente, est causée par diverses substances irritantes provoquant une inflammation, une rougeur, une sensation de chaleur, une enflure et de la douleur.
- Dans la dermite de contact allergique, des cellules immunitaires spécifiques sont impliquées et sont sensibilisées à une substance. Ainsi, ces cellules vont s'activer à chaque fois que la peau entre en contact avec cette substance et causer une réaction cutanée, rougeur de la peau, la formation de vésicules, une desquamation et la formation de croûtes. À la différence de la dermite irritative, la réaction peut apparaitre dans des régions du corps qui n'ont pas été en contact avec la substance allergène[23].
Constat
La méthylisothiazolinone est couramment utilisée dans les produits, parfois en conjonction avec la méthylchloroisothiazolinone, avec dans les deux cas la possibilité d'induire une dermatite de contact allergique. La sensibilisation à cette famille de conservateurs a été observée dès les années 1980. En raison de l'utilisation accrue de conservateurs isothiazolinone depuis 2005, les cas signalés de contacts allergiques à ce produit ont été, eux aussi, en forte augmentation.
- En 2013, la substance a été déclarée Allergène de contact de l'année 2013 (en), par l'American Contact Dermatitis Society[24],[25] et on observe un début d'épidémie en Europe[5].
- En 2015, une étude conduite dans huit pays européens (1er-) a montré que 6,0 % des personnes testées (205/3 434 patients) eu des réactions positive à ce produit (patch-test) et que la dermatite est localisée sur les mains dans 43,4 % des cas puis sur le visage (32,7 % de cas), les bras (14,6 %) et les paupières (11,7 %) mais 12,7 % des patients ont eu une dermatite généralisée. La majorité des patients (79 %) ont noté l'apparition de leur dermatite entre 2013 et 2015[5]. Dans la plupart des cas, l'allergie a été attribuée à des cosmétiques, mais 7,3 % des patients ont vu la réaction allergique apparaitre lorsqu'ils étaient dans des chambres nouvellement peintes et d'autres études ont montré que ce produit est aussi de plus en plus utilisé comme conservateur des peintures et enduits[2] (sans être mentionné par l'étiquette souvent)[5],[26].
Principe de précaution
Le , la société de cosmétiques Cosmetics Europe, après des discussions avec la Société européenne de la dermatite de contact (ESCD), a recommandé à ses membres de cesser l'utilisation de la méthylisothiazolinone (MIT), pour les produits dermatologiques y compris les lingettes humides. Cette action est recommandée, dans l'intérêt de la sécurité des consommateurs, en ce qui concerne les effets indésirables sur la peau. Il est recommandé aux entreprises concernées, de ne pas attendre une intervention réglementaire, en vertu du règlement cosmétique[27], mais de mettre en œuvre cette recommandation dès que possible[28].
Avis de la Commission européenne
Le , le comité scientifique de la Commission européenne sur la sécurité des consommateurs (SCCS), a émis un avis sur la sécurité des méthylisothiazolinones. Ce rapport ne considère que la question de la sensibilisation de contact. Le comité a conclu :
- les données cliniques actuelles indiquent qu'une concentration de 100 ppm (0,01 %), dans les produits cosmétiques, n'est pas sans danger pour le consommateur ;
- pour les produits cosmétiques (y compris les lingettes humides), aucune concentration sûre de sécurité, pour l'induction de l'allergie de contact ou son déclenchement, n'a été démontrée ;
- pour les produits cosmétiques, dits « à rincer », on considère qu'une concentration de 15 ppm (0,0015 %), est considérée comme sûre pour le consommateur, du point de vue de l'induction de l'allergie de contact. Cependant, aucune information n'est disponible quant au seuil de déclenchement[27] et des études ultérieures montreront que les produits à rinçage sont presque aussi souvent en cause que sans rincage[4].
Malgré des résultats d'études qui montrent tous sa responsabilité, en 2016 de nombreux produits cosmétiques (shampooing[29], gel douche, après-shampooing, crème de douche, lait de toilette, lessive, lingette, etc.), contiennent ce conservateur décrié[30],[31].
Neurotoxicité démontrée avec le modèle animal dès 2002
Depuis le début des années 2000, des études conduites par des neuroscientifiques ont montré que la méthylisothiazolinone, même à faible dose[32] est aussi « un biocide neurotoxique » et même « hautement toxique » pour les neurones en culture, bien que sans effets apparents pour les cellules gliales ; ce produit « perturbe l'association des tyrosine kinases de la famille SRC avec la kinase d'adhésion focale dans le développement des neurones corticaux »[33]. Il peut donc être à l'origine de troubles neurodégénératifs chez l'être humain.
En 2002, les résultats d'une étude[34] ont clairement montré (in vitro) qu'il n'y a pas besoin d'une exposition chronique pour générer cette neurotoxicité : une brève exposition suffit pour tuer les neurones mis en culture, via un processus toxique faisant intervenir le zinc et l'activation de la kinase régulée par le signal extracellulaire p44/42 (ERK) via une voie médiée par la 12-lipoxygénase[34]. Le processus de mort cellulaire implique aussi l'activation de la NADPH oxydase, la génération d'espèces réactives de l'oxygène, l'endommagement de l'ADN et la suractivation d'un enzyme : la Poly(ADP-ribose) polymérase, toutes se produisant en aval de la phosphorylation ERK[34].
En 2012, on a montré in vivo chez les têtards de Xenopus laevis qu'une exposition chronique de neurones lors de leur développement à de faibles doses de MIT (doses largement sublétales) interfère avec l'excroissance normale des neurites, c'est-à-dire de tous les prolongements du corps cellulaire du neurone (axone ou dendrite)[32]. Ceci s'est traduite par des anomalies neurocomportementales de l'animal, sans mortalité accrue (en aquarium) ni de réduction de la capacité natatoire, et sans défaut anatomique externe apparent, mais avec des déficits de comportement d'évitement visuel qui coïncident avec des anomalies électrophysiologiques dans la fonction optique du Colliculus supérieur, et une susceptibilité accrue à des crises de type épileptique)[32]. Les auteurs de cette étude, tout comme ceux de l'étude précédente (publiée dix ans plus tôt) ont invité à vérifier que d'autres biocides apparentés n'aient pas d'effets similaires sur les neurones, effets qui n'avaient pas été étudiés ni rapportés par la littérature scientifique avant 2002[32].
Excrétion et métabolites
Les analyses d'urines permettent de mettre en évidence un métabolite (acide N-methylmalonamique ou NMMA) de ce biocide et d'alors montrer qu'il y a eu passage percutané d'un produit en contenant (ou inhalation)[35].
Une étude de 2017 basée sur des volontaires humains en bonne santé a permis de préciser la cinétique déclination du NMMApar l'urine[36]
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Methylisothiazolinone » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Katarzyna Styszko et Krzysztof Kupiec (2018), The rate of biocide leaching from porous renders Author links open overlay, Chemical Engineering Research and Design, Elsevier Chemical Engineering Research and Design, vol. 132, avril 2018, p. 69-76, DOI:10.1016/j.cherd.2017.12.047, résumé.
- Bouschon, P. B., Waton, J. W. et Le Bouedec, M. F. (2017), Gestion de l’éviction des produits à risque et évaluation du nombre de rechutes parmi les patients ayant un eczéma allergique de contact à la méthylisothiazolinone entre 2010 et 2015, Revue Française d'Allergologie, 57(3), 241, résumé.
- Isaksson M., Gruvberger B. et Bruze M., « Occupational contact allergy and dermatitis from methylisothiazolinone after contact with wall covering glue and after a chemical burn from a biocide », Dermatitis, vol. 15, no 4, , p. 201–205 (PMID 15842065, DOI 10.2310/6620.2004.04017)
- (en) Jakob F. Schwensen, Wolfgang Uter, Magnus Bruze, C. Svedman, An Goossens, Mark Wilkinson, Ana Giménez Arnau, Margarida Gonçalo, Klaus E. Andersen, Evy Paulsen, Tove Agner, Caterina Foti, Kristiina Aalto‐Korte, John McFadden, Ian White et Jeanne D. Johansen, « The epidemic of methylisothiazolinone : a European prospective study » [« l'épidémie de méthylisothiazolinone : une étude prospective européene »], Contact dermatitis, vol. 76, no 5, , p. 272-279 (DOI 10.1111/cod.12733, lire en ligne)
- (en) J.F. Schwensen, C. Menné Bonefeld, C. Zachariae, C. Agerbeck, T.H. Petersen, C. Geisler, U.E. Bollmann, K. Bester et J.D. Johansen, « Cross‐reactivity between methylisothiazolinone, octylisothiazolinone and benzisothiazolinone using a modified local lymph node assay », British Journal of Dermatology, vol. 176, no 1, , p. 176-183 (DOI 10.1111/bjd.14825, lire en ligne)
- Collier P.J., Ramsey A., Waigh R.D., Douglas K.T., Austin P., Gilbert P., « Chemical reactivity of some isothiazolone biocides », Journal of Applied Bacteriology, vol. 69, no 4, , p. 578–584 (PMID 2292521, DOI 10.1111/j.1365-2672.1990.tb01551.x)
- Harino H., Mori Y., Yamaguchi Y., Shibata K., Senda T., « Monitoring of antifouling booster biocides in water and sediment from the port of Osaka, Japan », Arch. Environ. Cont. Toxicol., vol. 48, no 3, , p. 303–310 (PMID 15750770, DOI 10.1007/s00244-004-0084-2)
- Bellas J., « Comparative toxicity of alternative antifouling biocides on embryos and larvae of marine invertebrates », Sci. Total Environ., vol. 367, nos 2–3, , p. 573–85 (PMID 16545431, DOI 10.1016/j.scitotenv.2006.01.028)
- Rohm and Haas, Toxicology Department, Evaluation of the toxicity of Kathon biocide, août 1984
- Podmore P., « An epidemic of isothiazolinone sensitization in a flax spinning mill », Contact Dermatitis, vol. 38, no 3, , p. 165–1666 (PMID 9536412, DOI 10.1111/j.1600-0536.1998.tb05687.x)
- Environmental Protection Agency (1998). R.E.D. Facts, Methylisothiazolinone. Publication EPA-738-F-98-008
- Kresmann S., Arokia A.H.R, Koch C. et Sures B. (2018), Ecotoxicological potential of the biocides terbutryn, octhilinone and methylisothiazolinone: Underestimated risk from biocidal pathways?, Science of The Total Environment, 625, 900-908, résumé.
- Capkin, E., Ozcelep, T., Kayis, S. et Altinok, I. (2017), Antimicrobial agents, triclosan, chloroxylenol, methylisothiazolinone and borax, used in cleaning had genotoxic and histopathologic effects on rainbow trout, Chemosphere, 182, 720-729.
- Van Huizen, A. V., Tseng, A. S. et Beane, W. S. (2017), Methylisothiazolinone toxicity and inhibition of wound healing and regeneration in planaria. Aquatic Toxicology, 191, 226-235, résumé.
- Kresmann, S., Arokia, A. H. R., Koch, C. et Sures, B. (2018), Ecotoxicological potential of the biocides terbutryn, octhilinone and methylisothiazolinone: Underestimated risk from biocidal pathways?, Science of The Total Environment, 625, 900-908
- Yazar, K., Lundov, M. D. et Faurschou, A. (2017), Methylisothiazolinone in rinse-off products causes allergic contact dermatitis: a repeated open-application study, vol. 173, p. 115, 2015, British Journal of Dermatology, 176(5), 1416-1416.
- Lynch, M. D., White, J. M., Mcfadden, J. P., Wang, Y., White, I. R., Banerjee, P., … et Langan, S. M. (2017). BJD A dynamic landscape of allergen associations in delayed-type cutaneous hypersensitivity Hospitalization, inpatient burden and comorbidities associated with bullous pemphigoid in the USA Cross-reactivity between methylisothiazolinone, octylis.
- Park, E. J., Kim, S. et Chang, J. (2018), Methylisothiazolinone may induce cell death and inflammatory response through DNA damage in human liver epithelium cells. Environmental Toxicology, 33(2), 156-166.
- Rothe, H., Ryan, C. A., Page, L., Vinall, J., Goebel, C., Scheffler, H., … et Kern, P. S. (2017), Application of in vitro skin penetration measurements to confirm and refine the quantitative skin sensitization risk assessment of methylisothiazolinone, Regulatory Toxicology and Pharmacology, 91, 197-207.
- (en) S. Hosteing et al., « Outbreak of contact sensitization to methylisothiazolinone: an analysis of French data from the REVIDAL-GERDA network », Contact dermatitis, vol. 70, no 5, , p. 262-9 (PMID 24731083, DOI 10.1111/cod.12207, lire en ligne, consulté le ).
- Aude Lecrubier, « Eczéma : la méthylisothiazolinone déclarée allergène de l’année 2013 », Medscape, 25 avril 2014, sur medscape.fr.
- Nha Uyen Nguyen-Luu, « Dermite (ou dermatite) de contact », sur allerg.qc.ca (consulté le ).
- (en) Castanedo-Tardana, « Methylisothiazolinone », sur ncbi.nlm.nih.gov, (consulté le ).
- (en) « American Contact Dermatitis Society (ACDS) », sur contactderm.org (consulté le ).
- Goodier, M. C., Ljungberg, L., Persson, C., Engfeldt, M., Bruze, M. et Warshaw, E. M. (2017), Allergic Contact Dermatitis From Methylisothiazolinone in Residential Wall Paint, Dermatitis, 28(4), 284-287.
- (en) European Commission - Scientific Committee on Consumer Safety (SCCS), « Opinion on Methylisothiazolinone (P94) » [PDF], sur ec.europa.eu/, (consulté le ).
- (en) Cosmetics Europe, « Cosmetics Europe Recommendation on MIT », sur cosmeticseurope.eu, (consulté le ).
- Gilmore, R., Shan, G. et Katta, R. (2017), Allergic contact dermatitis to methylisothiazolinone in hair care products: report of a case, Dermatology Online Journal, 23(8).
- Le Flacon, « Méthylisothiazolinone », sur leflacon.free.fr (consulté le ).
- Que choisir, « Tests de produits - janvier 2016 : Substances toxiques dans les cosmétiques », sur test-comparatif.quechoisir.org, (consulté le ).
- Spawn A. et Aizenman C.D. (2012), Abnormal visual processing and increased seizure susceptibility result from developmental exposure to the biocide methylisothiazolinone, Neuroscience, 205, 194-204, résumé.
- He, K., Huang, J., Lagenaur, C. F. et Aizenman, E. (2006), Methylisothiazolinone, a neurotoxic biocide, disrupts the association of SRC family tyrosine kinases with focal adhesion kinase in developing cortical neurons, Journal of Pharmacology and Experimental Therapeutics, 317(3), 1320-1329.
- Du, S., McLaughlin, B., Pal, S. et Aizenman, E. (2002), In vitro neurotoxicity of methylisothiazolinone, a commonly used industrial and household biocide, proceeds via a zinc and extracellular signal-regulated kinase mitogen-activated protein kinase-dependent pathway, Journal of Neuroscience, 22(17), 7408-7416.
- Schettgen, T., Bertram, J. et Kraus, T. (2017), Quantification of N-methylmalonamic acid in urine as metabolite of the biocides methylisothiazolinone and chloromethylisothiazolinone using gas chromatography-tandem mass spectrometry, Journal of Chromatography B, 1044, 185-193, résumé.
- Schettgen, T. et Kraus, T. (2017), Urinary excretion kinetics of the metabolite N-methylmalonamic acid (NMMA) after oral dosage of chloromethylisothiazolinone and methylisothiazolinone in human volunteers, Archives of toxicology, 91(12), 3835-3841.
Liens externes
- Reregistration Eligibility Decision of MIT by US EPA
- European Scientific Committee on Cosmetic Products and Non-Food Products Intended for Consumers (SCCNFP)
- Fiche INRS sur la méthylisothiazolinone et ses dérivés
- Portail de la chimie
- Portail de la biochimie
- Portail de la médecine