Méthode du biuret
La méthode du biuret est une méthode de dosage colorimétrique des protéines.
Principe
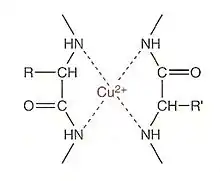
En milieu alcalin, les protéines qui possèdent au moins 4 liaisons peptidiques forment avec les ions cuivre II (Cu2+) un complexe bleu-violet dont l'intensité de la couleur est proportionnelle à la concentration en protéines. Cette coloration varie également en fonction de la nature des protéines à doser, de l’alcalinité du milieu, de la concentration en sulfate de cuivre et de la température. Un dosage colorimétrique est donc possible à 540 nm. Le réactif de coloration utilisé est le réactif de Gornall, composé :
- de sulfate de cuivre, qui donne la coloration bleu du réactif due aux ions cuivre à 3 mmol/L ;
- d'une solution d'hydroxyde de sodium (soude) à 0,2 mol/L, qui rend le milieu basique ;
- de tartrate double de sodium et de potassium, qui « chélate » (piège) les ions Cu2+ et évite leur précipitation en milieu alcalin sous forme d'hydroxyde de cuivre Cu(OH)2 insoluble ;
- d'iodure de potassium, pour éviter la réduction des ions cuivriques avant le dosage.
Mode opératoire
Le protocole à suivre pour réaliser un dosage par la méthode du biuret est le suivant : mélanger 3 ml du réactif de Gornall à 2 ml de différentes solutions protéiques de concentrations connues. Incuber ensuite à 37 °C pendant 30 min à l’obscurité. Laisser refroidir puis mesurer les absorbances des solutions à 540 nm. Ceci permet d’obtenir une gamme étalon et de tracer la courbe étalon afin de déterminer la concentration en protéines d’une solution inconnue traitée de la même manière.
Avantages
Cette méthode peut être utilisée pour un dosage qualitatif, qui peut être quantitatif lorsque l’on dispose de solutions de protéines pures. Elle est qualitative puisque le maximum d'absorption de la coloration varie avec le nombre de liaisons peptidiques présentes dans la molécule. Elle est quantitative parce que l'intensité de l'absorption est proportionnelle à la concentration protidique.
Enfin, elle est relativement rapide et peu onéreuse face à la méthode de Kjeldahl qui requiert, au préalable, une minéralisation des protéines.
Inconvénients
Cette méthode possède un seuil de quantification élevé (0,6 mg par litre), et nécessite donc que la solution à étudier soit assez concentrée. De plus, cette réaction spécifique des polypeptides, peut également se produire avec des tripeptides et fausser les mesures. Elle n’est pas non plus utilisable pour le dosage des glycoprotéines. Enfin, la présence d’ammoniac dans la solution inconnue peut interférer avec la réaction en formant des complexes avec le cuivre et fausser les résultats.

Une durée de réaction d'environ 30 minutes à l'obscurité est nécessaire à l'obtention d'une coloration stable. La lecture étant spectrophotométrique, il faut cependant réaliser une gamme d'étalonnage ainsi que des témoins de compensation adaptés.
Utilisation
- Cette méthode permet d'obtenir un dosage rapide des protéines. Contrairement à la méthode de Kjeldahl (qui reste une méthode de référence légale), les protéines sont dosées sans minéralisation. La technique est donc plus facile à mettre en place et aussi moins onéreuse.
- Le dosage des protéines n'est pas applicable sur le lait car le lactose interfère dans le dosage (il réduit les ions cuivre (II)), et les protéines et le lactose ne peuvent être séparés.