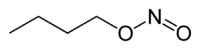
Nitrite de butyle
Le nitrite de butyle ou nitrite de n-butyle est un composé de la famille des nitrites d'alkyle, dérivé du butan-1-ol (n-butanol). Il est notamment utilisé en usage récréatif comme poppers.
| Nitrite de butyle | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 1-nitrosooxybutane | |
| Synonymes |
nitrite de n-butyle |
|
| No CAS | ||
| No ECHA | 100.008.057 | |
| No CE | 208-862-1 | |
| PubChem | 10996 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide huileux jaunâtre[1] | |
| Propriétés chimiques | ||
| Formule | C4H9NO2 [Isomères] |
|
| Masse molaire[2] | 103,119 8 ± 0,004 6 g/mol C 46,59 %, H 8,8 %, N 13,58 %, O 31,03 %, |
|
| Propriétés physiques | ||
| T° ébullition | 78 °C (décomposition) [1] | |
| Solubilité | faiblement soluble dans l'eau [1] | |
| Masse volumique | 0,88 g·cm-3 à 20 °C [1] | |
| Point d’éclair | 10 °C (coupelle fermée)[1] | |
| Thermochimie | ||
| ΔfH0gaz | −34,8 kcal·mol-1 [3] | |
| ΔfH0liquide | −43,6 kcal·mol-1 [3] | |
| ΔvapH° | 8,8 kcal·mol-1 [3] | |
| PCI | −639,6 kcal·mol-1[3] | |
| Précautions | ||
| SGH[1] | ||
  Danger |
||
| Transport[1] | ||
| Écotoxicologie | ||
| DL50 | 83 mg·kg-1 (rat, oral)[4] 171 mg·kg-1 (souris, oral)[5] 158 mg·kg-1 (souris, i.p.)[6] |
|
| CL50 | 1,77 mg/l/4 h (rat, inhalation)[7] | |
| LogP | 2,350[8] | |
| Caractère psychotrope | ||
| Catégorie | Dépresseur faible | |
| Mode de consommation |
Inhalation |
|
| Autres dénominations |
voir Poppers |
|
| Risque de dépendance | Faible | |
| Composés apparentés | ||
| Autres composés |
Nitrite d'amyle, nitrite de pentyle |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
Propriétés physico-chimiques
C'est un composé facilement inflammable, dont les vapeurs forment des mélanges explosifs avec l'air. Il est moins dense que l'eau et y est faiblement soluble[1].
Production et synthèse
Le nitrite de butyle peut être synthétisé par réaction entre l'acide nitreux (formé in situ par réaction entre un nitrité métallique et un acide minéral) et le butan-1-ol.
- HNO2 + C4H9OH → C4H9ONO + H2O
Utilisation
Le nitrite de butyle est utilisé en synthèse organique, comme source en ion NO+. Il est notamment utilisé pour la synthèse du cupferron.
Le nitrite de butyle est l'un des composés utilisés comme poppers.
Notes et références
- Entrée « Butyl nitrite » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 1/2/2011 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) L. Batt, K. Christie, R.T. Milne et A.J. Summers, « Heats of formation of C1-C4 alkyl nitrites (RONO) and their RO-NO bond dissociation energies », International Journal of Chemical Kinetics, vol. 20, no 6, , p. 877-885 (DOI 10.1002/kin.550060610)
- JAT, Journal of Applied Toxicology. Vol. 1, Pg. 30, 1981. PMID
- Research Communications in Substances Abuse. Vol. 3, Pg. 233, 1982.
- Research Communications in Chemical Pathology and Pharmacology. Vol. 26, Pg. 75, 1979 PMID
- Fundamental and Applied Toxicology. Vol. 8, Pg. 101, 1987.
- (en) « Nitrite de butyle », sur ChemIDplus, consulté le 1er février 2011
- Portail de la chimie
