Nitrosylation
La nitrosylation est la liaison covalente de monoxyde d'azote sur une molécule, généralement organique, pour former un composé nitroso. On l'obtient in vitro par exposition à l'acide nitreux HNO2 ou à un équivalent efficace, par exemple une solution de nitrite de sodium NaNO2 et d'acide chlorhydrique HCl.
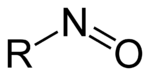
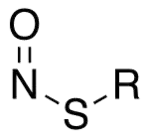
Une classe particulière de nitrosylation, qui joue un rôle important en biologie moléculaire, implique les groupes thiol –SH pour former des S-nitrosothiols –SNO. Il s'agit de la S-nitrosylation, qui est une modification post-traductionnelle de certaines protéines sur quelques-uns de leurs résidus de cystéine. La S-nitrosylation intervient dans des processus et systèmes biochimiques fondamentaux tels que la signalisation cellulaire[1], la neurotransmission[2], le système immunitaire[3] ou encore l'apoptose[4],[5].
Notes et références
- (en) Douglas T. Hess, Akio Matsumoto, Sung-Oog Kim, Harvey E. Marshall et Jonathan S. Stamler, « Protein S-nitrosylation: purview and parameters », Nature Reviews Molecular Cell Biology, vol. 6, no 2, , p. 150-166 (PMID 15688001, DOI 10.1038/nrm1569, lire en ligne)
- (en) Samie R. Jaffrey, Hediye Erdjument-Bromage, Christopher D. Ferris, Paul Tempst et Solomon H. Snyder, « Protein S-nitrosylation: a physiological signal for neuronal nitric oxide », Nature Cell Biology, vol. 3, no 2, , p. 193-197 (PMID 11175752, DOI 10.1038/35055104, lire en ligne)
- (en) Yasuomi Tada, Steven H. Spoel, Karolina Pajerowska-Mukhtar, Zhonglin Mou, Junqi Song, Chun Wang, Jianru Zuo et Xinnian Dong, « Plant Immunity Requires Conformational Charges of NPR1 via S-Nitrosylation and Thioredoxins », Science, vol. 321, no 5891, , p. 952-956 (PMID 18635760, PMCID 3833675, DOI 10.1126/science.1156970, Bibcode 2008Sci...321..952T, lire en ligne)
- (en) Gerry Melino, Francesca Bernassola, Richard A. Knight, Maria Tiziana Corasaniti, Giuseppe Nistic et Alessandro Finazzi-Agr, « S-nitrosylation regulates apoptosis », Nature, vol. 388, no 6641, , p. 432-433 (PMID 9242400, DOI 10.1038/41237, Bibcode 1997Natur.388..432M, lire en ligne)
- (en) Jianrong Li, Timothy R. Billiar, Robert V. Talanian et Young M. Kim, « Nitric oxide reversibly inhibits seven members of the caspase family via S-nitrosylation », Biochemical and Biophysical Research Communications, vol. 240, no 2, , p. 419-424 (PMID 9388494, DOI 10.1006/bbrc.1997.7672, lire en ligne)
- Portail de la biochimie
- Portail de la chimie