Noir Ériochrome T
Le Noir Ériochrome T (en abrégé : NET) est un indicateur coloré quasiment exclusivement utilisé lors des dosages d'ions métalliques en solution par complexation, par exemple pour déterminer la dureté de l'eau.
| Noir Ériochrome T | ||
| ||
 | ||
| Echantillon de Noir Ériochrome T | ||
| Identification | ||
|---|---|---|
| Nom UICPA | (4Z)-4-[(1-hydroxynaphthalén-2-yl- hydrazinylidène]-7-nitro-3-oxo Y-naphtalène-1-sulfonate de sodium | |
| Synonymes |
NET |
|
| No CAS | ||
| No ECHA | 100.015.683 | |
| PubChem | 5351620 | |
| SMILES | ||
| InChI | ||
| Apparence | poudre noire | |
| Propriétés chimiques | ||
| Formule | C20H12N3NaO7S [Isomères] |
|
| Masse molaire[1] | 461,38 ± 0,025 g/mol C 52,06 %, H 2,62 %, N 9,11 %, Na 4,98 %, O 24,27 %, S 6,95 %, |
|
| pKa | pKa1=6,2, pKa2=11,6 à 25 °C | |
| Propriétés physiques | ||
| Solubilité | 50 g·L-1 (dans l'eau, à 20 °C) 2 g·L-1 (dans l'éthanol, à 20 °C) |
|
| Précautions | ||
| SGH | ||
  Attention |
||
| Directive 67/548/EEC | ||
 Xi  N |
||
| Transport | ||
| Écotoxicologie | ||
| DL50 | 17 590 mg·kg-1 (chez le rat, oral) | |
| CL50 | 6 mg·L-1 (poissons, pour 96 h) | |
| Unités du SI et CNTP, sauf indication contraire. | ||
La dénomination de cette espèce chimique était à l'origine une marque déposée de la société commerciale Huntsman Petrochemical, LLC[2].
Caractéristiques
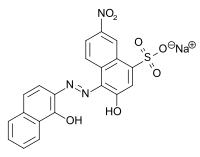
Le Noir Ériochrome T est un colorant azoïque mis en évidence par la présence d'un groupement azoïque (avec le groupe fonctionnel N=N).
Sa formule chimique partiellement développée peut s'écrire :
- HOC10H6N=NC10H4(OH)(NO2)SO3Na.

Sous sa forme libre (sa forme protonée) et à pH = 10, cet indicateur est bleu pâle.
Il devient rouge rosé quand il forme un complexe avec l'ion calcium ou l'ion magnésium (ou plus rarement d'autres ions métalliques).
Applications

La principale utilisation du Noir Ériochrome T est celle d'indicateur de fin de réaction lors d'un dosage par titrage colorimétrique par l'EDTA[3]. Le repérage de l'équivalence, et donc le passage à la forme bleue, s'obtient lorsqu'assez d'EDTA est ajouté et que les ions calcium et/ou magnésium forment des complexes avec l'EDTA plutôt qu'avec le NET. Ce dernier se trouve alors sous sa forme libre (c'est-à-dire non compléxée).
Dans un contexte scientifique plus approfondi, le Noir Ériochrome T a également été utilisé pour détecter la présence des terres rares[4].
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Exemple de page commerciale du NET mentionnant cette dénomination (cf. Description, Legal Information) ».
- « Exemple de dosage par titrage colorimétrique avec le NET pour détermination de la durété de l'eau (Niveau BTS) ».
- (en) Dubenskaya, L. O. and Levitskaya, G. D., « Use of Eriochrome Black T for the polarographic determination of rare-earth metals », Journal of Analytical Chemistry, vol. 54, no 7, , p. 655–657 (ISSN 1061-9348, lire en ligne)
Liens externes
Articles connexes
- Portail de la chimie
