Formule de Lewis
En chimie, une structure de Lewis est une représentation en deux dimensions de la structure électronique externe des atomes composant une molécule. Inventée par Gilbert Lewis, elle se base sur la topologie de la molécule (connexion entre les atomes par des liaisons covalentes). Elle concerne les atomes du groupe principal.
Définition
La structure de Lewis consiste à définir la localisation des électrons sur ou entre les atomes de la molécule. Seuls les électrons de valence sont considérés. On obtient ainsi une certaine vision de la structure électronique de la molécule par ses doublets libres, ses doublets liants (liaisons σ et π), ses lacunes et ses éventuels électrons célibataires (dans le cas des radicaux).
Un code de représentation

Dans cette représentation, les électrons célibataires sont notés par des points et les paires d'électrons par des traits (plus rarement par deux points). Les traits peuvent être localisés sur un atome (doublet libre ou non liant) ou entre les atomes (doublet liant, liaison covalente).
Construction
Deux types de construction sont envisageables soit en faisant le maximum de liaison, soit en imposant l'octet. Dans tous les cas, une structure de Lewis est d'autant plus probable que :
- Elle respecte l'octet ;
- Elle ne présente pas de séparation de charge ;
- Les éventuelles charges sont cohérentes avec l'électronégativité des atomes.
Les deux approches présentées ici se basent sur un squelette σ bien défini.
Construction par le maximum de liaison

Cette approche est la plus courante, et la plus rapide à utiliser. Elle se fait en trois étapes :
- Écrire les structures électroniques des atomes (à ce stade les paires d'électrons peuvent être dé-appariées — comme dans le carbone de CO2) ;
- Relier un maximum de paires d'électrons (en respectant l'octet - paires libres ou paires liantes). Les liaisons du squelette doivent apparaitre dans cet appariement ;
- Vérifier l'octet (cette approche assure d'avoir la neutralité des atomes, mais pas le respect de l'octet).
Remarque : cette approche conduit parfois à des hypervalences mal contrôlées car dé-apparier les paires d'électrons des atomes est parfois délicat. L'octet n'est pas garanti et doit être vérifié.
Construction par l'octet imposé
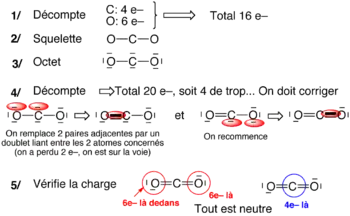
Cette approche (qui est plus longue à appliquer) est la plus systématique. Elle conduit toujours à une bonne structure de Lewis car l'octet est imposé[1].
Cette approche se fait en cinq étapes :
- Compter le nombre total d'électrons de valence (n) ;
- Composer le squelette de la molécule ;
- Compléter à l'octet partout ;
- Compter le nombre d'électrons présents dans le schéma trouvé à l’étape précédente (étape 3), et comparer à n :
- s'il manque des électrons, rajouter une paire libre sur l'atome pouvant être hypervalents,
- s'il y a trop d'électrons, ôter deux paires libres adjacentes et les remplacer par une liaison entre les atomes concernés (liaison multiples) ;
- Compter les charges, et réduire l'excès de charge plus ou moins adjacentes en prenant un doublet libre du – et en faisant une liaison multiple vers son voisin + (si ce voisin peut être hypervalent).
Cas où cette représentation est mise en défaut
Une structure de Lewis n'est qu'une représentation simplifiée de la structure électronique. En général les erreurs se corrigent par la prise en compte de plusieurs structures de Lewis (comme dans CO2−), on parle de mésomérie. On rencontre cependant quelques cas, emblématiques, où cette écriture est mise en défaut, et ne peut être corrigée simplement.
C'est le cas du dioxygène. Pour cette molécule, la représentation de Lewis donne : ![]() . Dans cette représentation, chaque électron se trouve en apparié (sous forme de doublet), ce qui donnerait à la molécule de dioxygène des propriétés diamagnétiques. Or celle-ci est paramagnétique, c'est-à-dire qu'elle présente des électrons non-appariés.
. Dans cette représentation, chaque électron se trouve en apparié (sous forme de doublet), ce qui donnerait à la molécule de dioxygène des propriétés diamagnétiques. Or celle-ci est paramagnétique, c'est-à-dire qu'elle présente des électrons non-appariés.
Exceptions à la règle de l'octet
- Les atomes de la colonne 13 (bore, aluminium, etc.) sont souvent électrodéficients : il s'agit d'une violation par défaut de la règle de l'octet. Ces atomes ont exactement six électrons autour d'eux, on parle d'une lacune (représentée par un petit rectangle vide). Le bore et les carbocations ont une lacune. La lacune confère à l'atome une acidité particulière pour les électrons voisins (acidité de Lewis).
- À partir de l'élément silicium, les atomes peuvent outrepasser la règle de l'octet. On parle alors d'« hypervalence » (exemples : PCl5, SF4). Les atomes concernés sont particulièrement le soufre, le phosphore, le xénon).
- Les atomes d'hydrogène ont au maximum deux électrons autour d'eux. On parle pour eux de « règle du duet ».
Malgré ses limites, la structure de Lewis est un outil indispensable pour les chimistes et permet d'expliquer la composition et la réactivité de nombreux composés, surtout en chimie organique.
Exemples
Octet respecté
Octet non respecté par excès
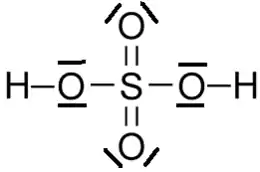
Molécule d'acide sulfurique
Lacune électronique (exemple de BH3)

Octet imposé et hypervalence

- Isomérie
L'isomérie H-C#N H-(+)N#C(-) montre que des structures de Lewis peuvent parfois aider à déterminer la connectivité d'une molécule.
Notes et références
Références
- Zumdahl, Chimie générale, 2e éd., éd. de Boeck, 1998, p. 270.