Ovogénèse et embryogenèse de la drosophile
L'ovogenèse et l'embryogenèse de la drosophile sont les processus de développement de l'ovocyte de la drosophile, puis la mise en place des organes après la fécondation. Chez cette espèce la mise en place des axes antéro-postérieur et dorsaux-ventral se fait avant la fécondation.
La drosophile est un organisme modèle en génétique et biologie du développement. Elle est utilisée pour sa petite taille et son cycle de vie court, sa descendance nombreuse. La transparence de l'embryon facilite également son étude. La drosophila melanogaster fut introduite dans les expérimentations génétiques par Thomas Hunt Morgan en 1909.
Cycle de vie
La drosophile présente une méthode holométabolique de développement, ce qui signifie qu'il y a trois étapes distinctes de la vie post-embryon, chacune de ces étapes modifiant radicalement la structure et l'agencement du corps : larve, nymphe et adulte. Les mécanismes nécessaires pour les fonctions vitales et la transition douce entre ces trois phases se développe durant l’embryogenèse. Durant cette phase, la drosophile sous forme de larve va se développer et éclore sous la forme d'une première larve. Les cellules qui produiront l'adulte sont mises de côté dans des disques imaginaux. Durant la période en tant que nymphe, le corps de la larve se sépare parallèlement à l'augmentation de la taille des disques imaginaux et produit le corps adulte. Ce processus s'appelle la métamorphose.
Environ 24 heures après la fertilisation, les œufs sont devenues des larves qui mue trois fois en 5,5 à 6 jours pour devenir une nymphe. La nymphe se métamorphose en mouche adulte en 3,5 à 4,5 jours. Le processus entier entre l’œuf et la mouche adulte prend entre 10 et 12 jours à une température de 25 °C[1].
Ovogenèse

L'ovogenèse se déroule dans les ovarioles de la femelle. Les cellules souches germinales se divisent de façon asymétrique pour donner une nouvelle cellule souche et un cystoblaste. Il y a formation d'un syncitium de 16 cystocytes appelé cyste. L'un des cystes se différentie en ovocyte et les 15 autres en cellules nourricières. L'ovocyte migre vers la région postérieur. L'axe-antéro-postérieur est donc mis en place avant la fécondation (de même que l'axe dorso-ventral). Des ponts cytoplasmiques relient les cellules, ce qui permet aux cellules nourricières de transférer des ARNm à l'ovocyte. Les cellules folliculaires et nourricières disparaissent avant la fécondation.
Le noyau de l'ovocyte produit de l'ARNm Gurken. Il est ensuite traduit en protéine dans le cytoplasme. Il se lie alors à son ligand, le récepteur torpédo situé à la membrane des cellules folliculaires postérieur. Cela induit une réorganisation des microtubules qui ont alors leur extrémité (-) dans la partie antérieure de l'ovocyte et leur extrémité (+) dans la partie postérieure. Cette réorganisation permet la croissance cellulaire et le repositionnement du noyau dans l'extrémité antérieure-dorsale.
Mise en place de l'axe dorso-ventral

Les cellules folliculaires sécrètent un protéine appelée Pipe qui ventralise l'embryon. Lorsque le noyau migre sur les microtubes, il entraîne avec lui un amas de Gurken. Lorsque cette protéine se lie au récepteur Torpédo des cellules folliculaire, elle inhibe l'expression de Pipe dans l'ovocyte. Gurken permet donc l'inhibition de la ventralisation dans la zone dorsale de l'ovocyte, lors de son trajet avec le noyau.
Mise en place de l'axe antério-postérieur
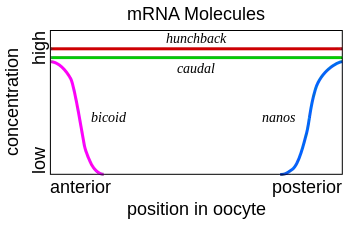
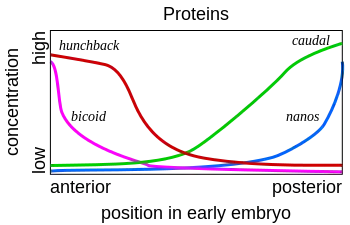
L'ARNm Bicoid est synthétisé dans les cellules nourricières, puis est transféré dans l'ovocyte grâce aux microtubules. Il est fixé au cortex cellulaire, ce qui lui permet de ne pas se répandre dans toute la cellule. Cet ARNm est ensuite traduit en protéine. La protéine Bicoid est un facteur de transcription qui active notamment la transcription du gène Hunchback. Elle est exprimée dans l'ovocyte selon un gradient de concentration, avec une forte expression dans la région antérieure. Elle permet donc la mise en place d'un gradient de concentration de la protéine Hunchback. Une forte concentration de cette protéine permet de former les structures antérieures de l'embryon. La protéine Bicoid permet également d'inhiber la traduction de l'ARNm Caudal, la protéine Caudal permettant de former les structures postérieures de l'embryon.
Le même mécanisme est mis en place dans la région postérieure avec d'autres protéines. L'ARNm de Nanos est produit dans les cellules nourricières puis migre dans la partie postérieure de l'embryon. Il est attaché au cortex cellulaire de la même façon que Bicoid. La protéine Nanos empêche la traduction de l'ARNm Hunchback.
Sources
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Drosophila embryogenesis » (voir la liste des auteurs).
Références
- Russell 2009, p. 564
Bibliographie
- Peter J. Russell, iGenetics: A Molecular Approach, Benjamin Cummings, , 848 p. (ISBN 978-0321569769)
- Portail de la biologie