Pentoxyde de phosphore
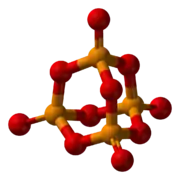
L'hémipentoxyde de phosphore, souvent simplement appelé, par abus de langage, pentoxyde de phosphore, ou anciennement anhydride phosphorique, est l'oxyde de phosphore longtemps connu sous la formule P2O5 (ce qui explique son nom), mais dont la formule brute correcte est P4O10 (dimère). C'est un composé fortement hygroscopique qui se transforme en acide phosphorique en s'hydratant, car il en est l'anhydride.
|
| Hémipentoxyde de phosphore | |

| |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.013.852 |
| No CE | 215-236-1 |
| Apparence | cristaux blancs, hygroscopiques ou poudre[1]. |
| Propriétés chimiques | |
| Formule | P2O5 ou P4O10 |
| Masse molaire[2] | 141,944 5 ± 0,001 5 g/mol O 56,36 %, P 43,64 %, 283,889 g mol-1 (P4O10) |
| Propriétés physiques | |
| T° fusion | 340 °C[1] |
| T° ébullition | Point de sublimation : 360 °C[1] |
| Solubilité | dans l'eau : réaction[1] |
| Masse volumique | 2,4 g·cm-3[1] |
| Précautions | |
| SGH[3] | |
 Danger |
|
| SIMDUT[4] | |
  D1A, E, |
|
| Transport | |
| Unités du SI et CNTP, sauf indication contraire. | |
Utilisations
Le pentoxyde de phosphore est utilisé comme très puissant déshydratant, par exemple pour la synthèse d'anhydride d'acide à partir d'acides carboxyliques selon la réaction R–COOH + R'–COOH → R–CO–O–CO–R' + H2O. Il ne peut cependant être utilisé que si les chaînes carbonées R et R' sont suffisamment simples. En effet on obtient lors de cette synthèse de l'acide phosphorique comme sous-produit. Au laboratoire, le pentoxyde de phosphore est aussi utilisé comme desséchant dans les dessiccateurs et pour la dessiccation de solvants extraits par chauffage à reflux.
Notes et références
- PENTOXYDE DE DIPHOSPHORE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Pentoxyde de phosphore » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009