Acide perfluorooctanesulfonique
L'acide perfluorooctanesulfonique (PFOS), dont la base conjuguée est l'anion perfluorooctanesulfonate, est un tensioactif fluoré de formule chimique C8F17SO3H. C'est un perturbateur endocrinien et un polluant inscrit à l'Annexe B de la Convention de Stockholm sur les polluants organiques persistants.
| Acide perfluorooctanesulfonique | |||
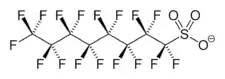  Anion perfluorooctanesulfonate |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | acide 1,1,2,2,3,3,4,4,5,5,6,6,7,7,8,8,8-heptadécafluorooctane-1-sulfonique | ||
| Synonymes |
acide perfluorooctylsulfonique |
||
| No CAS | (molécule neutre) (anion sulfonate) |
||
| No ECHA | 100.015.618 | ||
| No CE | 217-179-8 (molécule neutre) | ||
| PubChem | 74483 | ||
| ChEBI | 39421 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C8HF17O3S [Isomères] |
||
| Masse molaire[1] | 500,13 ± 0,012 g/mol C 19,21 %, H 0,2 %, F 64,58 %, O 9,6 %, S 6,41 %, |
||
| Précautions | |||
| SGH[2],[3] | |||
   Danger |
|||
| Transport[3] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Il dérive notamment du perfluorooctanesulfonamide C8F17SO2NH2 (PFOSA) et a constitué jusqu'au début du siècle l'ingrédient essentiel du traitement Scotchgard mis au point par la société 3M pour l'imperméabilisation des tissus, du mobilier et des tapis[4]. Il a également été utilisé pour traiter les papiers à contact alimentaire contre les taches d'eau et de graisse[5], ainsi que pour diverses autres applications grand public[6].
Il est produit à partir du fluorure de perfluorooctanesulfonyle C8F17SO2F. C'est une molécule amphiphile, avec une chaîne latérale à la fois hydrophobe et lipophobe, et un groupe sulfonate ou acide sulfonique terminal hydrophile. Il est particulièrement stable en raison de la force des liaisons carbone-fluor. C'est un tensioactif plus puissant que ceux à base d'hydrocarbures.
En 2009, PFOS, ses sels et fluorure de perfluorooctanesulfonyle ont été classés parmi les POPs (polluants organiques persistants), au titre de la Convention de Stockholm en raison de leur nature omniprésente, persistante, bioaccumulable et toxique[7].
Articles connexes
- L'acide perfluorooctanesulfonique est utilisé dans le Skydrol
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Bryan Boulanger, John D. Vargo, Jerald L. Schnoor et Keri C. Hornbuckle, « Evaluation of Perfluorooctane Surfactants in a Wastewater Treatment System and in a Commercial Surface Protection Product », Environmental Science and Technology, vol. 39, no 15, , p. 5524-5530 (lire en ligne) DOI:10.1021/es050213u
- (en) Hermann Fromme, Sheryl A. Tittlemier, Wolfgang Völkel, Michael Wilhelm et Dorothee Twardella, « Perfluorinated compounds – Exposure assessment for the general population in western countries », International Journal of Hygiene and Environmental Health, vol. 212, no 3, , p. 239-270 (lire en ligne) DOI:10.1016/j.ijheh.2008.04.007
- (en) Geary W. Olsen, Timothy R. Church, Eric B. Larson, Gerald van Belle, James K. Lundberg, Kristen J. Hansen, Jean M. Burris, Jeffrey H. Mandel et Larry R. Zobel, « Serum concentrations of perfluorooctanesulfonate and other fluorochemicals in an elderly population from Seattle, Washington », Chemosphere, vol. 54, no 11, , p. 1599-1611 (PMID 14675839, DOI 10.1016/j.chemosphere.2003.09.025, lire en ligne)
- (en-GB) « Information on the 16 chemicals added to the Stockholm Convention – Perfluorooctane sulfonic acid (PFOS), its salts and perfluorooctane sulfonyl fluoride (PFOS-F) », sur pops.int (consulté le )
- Portail de la chimie
- Portail de l'écotoxicologie
