PROTAC
Les PROTACs (proteolysis-targeting chimeras) sont de petites molécules bi-bifonctionnelles, conçues pour induire la dégradation d’une protéine pathogène par le système ubiquitine protéasome en recrutant simultanément une ubiquitine ligase (E3) et une protéine cible.[1]
Ces molécules pourraient s'inscrire dans une nouvelle stratégie de découverte de médicaments basée sur le concept du recrutement simultanément d’une enzyme ubiquitine ligase et d’une protéine cible par une petite molécule chimique[2],[3]. Ce recrutement permet le rapprochement spatial et l’induction d’une interaction protéine-protéine (PPI) non physiologique entre l’ubiquitine ligase à la protéine cible forçant l’ubiquitination de celle-ci et donc sa dégradation spécifique par le système ubiquitine protéasome.
Découverte
2001
La première preuve de concept PROTAC a été publiée par le laboratoire de C.Crews et R. J. Deshaies en 2001 sous le nom de PROTAC-1. La molécule était composée d’une part, d’un inhibiteur de l'angiogenèse, l'ovalicine, ligand covalent de l'aminopeptidase‑2 méthionine (MetAP‑2) et d’autre part de IκBα, un phospho-peptide naturel de 18 unités reconnu par la ligase E3, SCFβ-TRCP
PROTAC-1 souffrait d'une faible perméabilité cellulaire et donc d'une faible activité, ce qui a limité la technologie PROTAC dans le développement de nouvelles thérapies.[4]
2008
La première petite molécule PROTAC, c’est-à-dire composée uniquement de petites molécules, a été décrite en 2008. Ce PROTAC permettait le recrutement de la ligase MDM2 grâce à un inhibiteur de d’interaction protéine-protéine connu de cette ligase, la nutlin, et un ligand SARM (modulateur sélectif des récepteurs aux androgènes), ligand non stéroïdien des récepteurs aux androgènes (AR) provoquant l’ubiquitination de ce récepteur aux androgènes (AR) et sa dégradation par le protéasome.[5]
Mécanisme d'action
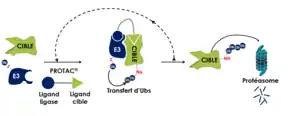
Le mode d’action d’un PROTAC est de nature catalytique et se fait en plusieurs étapes successives. Premièrement, il y a une fixation simultanée de la molécule sur la protéine à dégrader et l’ubiquitine ligase E3 ciblée. La fixation simultanée de ces deux protéines par la molécule PROTAC va permettre la formation d'un complexe à trois parties, appelé complexe ternaire, et donc permettre le rapprochement spatial des deux protéines et l’induction d’une interaction protéine-protéine non physiologique entre la cible et l’E3. Une fois le complexe ternaire stabilisé il y aura transfert d'unités d'ubiquitines une par une jusqu’à la formation d'une chaine d'ubiquitine. Cette chaîne d'ubiquitines étant un marqueur de dégradation des protéines, la dernière étape est l’adressage de cette protéine polyubiquitinée au protéasome 26S, par l’intermédiaire de sa particule régulatrice 19S, provoquant sa dégradation.[1]
Notes et références
- Ian Churcher, « Protac-Induced Protein Degradation in Drug Discovery: Breaking the Rules or Just Making New Ones? », Journal of Medicinal Chemistry, vol. 61, no 2, , p. 444–452 (ISSN 1520-4804, PMID 29144739, DOI 10.1021/acs.jmedchem.7b01272, lire en ligne, consulté le )
- Académie nationale de pharmacie, « Veille scientifique, Lettre de veille N°67 », Lettre, , p. 5 (lire en ligne)
- « De nouvelles molécules présentent un potentiel pour les futures thérapies contre le cancer », sur Clinique Amberieu : L'information médicale par des professionnels de la santé, (consulté le )
- (en) Kathleen M. Sakamoto, Kyung B. Kim, Akiko Kumagai et Frank Mercurio, « Protacs: Chimeric molecules that target proteins to the Skp1–Cullin–F box complex for ubiquitination and degradation », Proceedings of the National Academy of Sciences, vol. 98, no 15, , p. 8554–8559 (ISSN 0027-8424 et 1091-6490, PMID 11438690, DOI 10.1073/pnas.141230798, lire en ligne, consulté le )
- (en) « Targeted intracellular protein degradation induced by a small molecule: En route to chemical proteomics », Bioorganic & Medicinal Chemistry Letters, vol. 18, no 22, , p. 5904–5908 (ISSN 0960-894X, DOI 10.1016/j.bmcl.2008.07.114, lire en ligne, consulté le )
- Nicolas Kraupner, « PROTAC®, une application innovante des petites molécules en drug-discovery », PharmD, université de Lille, (DOI 10.13140/RG.2.2.20171.92969, lire en ligne, consulté le )
- Portail de la biologie cellulaire et moléculaire