Pentachlorure de phosphore
Le pentachlorure de phosphore est un composé du phosphore au degré d'oxydation V. C'est un chlorure de l'acide phosphorique.
| Pentachlorure de phosphore | |||
| |||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.030.043 | ||
| No CE | 233-060-3 | ||
| SMILES | |||
| InChI | |||
| Apparence | poudre cristalline jaune pâle, d'odeur âcre |
||
| Propriétés chimiques | |||
| Formule | PCl5 | ||
| Masse molaire[1] | 208,239 ± 0,01 g/mol Cl 85,13 %, P 14,87 %, |
||
| Propriétés physiques | |||
| T° fusion | Point de sublimation : 100 °C[2] décomposition à 167 °C |
||
| Solubilité | Réagit avec l'eau | ||
| Masse volumique | 2 100 kg/m3 | ||
| Pression de vapeur saturante | à 55,5 °C : 133 Pa[2] | ||
| Précautions | |||
| SGH[3] | |||
   Danger |
|||
| SIMDUT[4] | |||
   D1A, E, F, |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Inhalation | œdème pulmonaire | ||
| Peau | peut être absorbée | ||
| Écotoxicologie | |||
| DL50 | 660 mg·kg-1 (rats, oral) | ||
| Valeur d'exposition | 1 mg·m-3 | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
Structure[5]
Structure géométrique
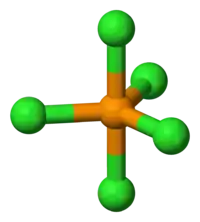
PCl5 a une structure bipyramide trigonale en accord avec sa formule VSPER AX5. Il présente donc deux types de chlore : les trois atomes de chlore équatoriaux (à 120° les uns des autres) et les deux atomes de chlore apicaux.
Labilité de la structure
Comme de nombreuses structures bipyramide trigonales, PCl5 a une structure labile, c'est-à-dire que par une pseudorotation de Berry, les deux atomes de chlore apicaux s'échangent avec deux atomes de chlore équatoriaux. Le troisième, inchangé, est appelé pivot de la pseudorotation.
Propriétés chimiques
Réaction avec l'eau
Au contact de l'eau, le pentachlorure de phosphore s'hydrolyse et se transforme en chlorure d'hydrogène et en l'acide phosphorique. L'équation de la réaction s'écrit :
PCl5 + 4 H2O → H3PO4 + 5 HCl
Réaction avec les alcools
PCl5 est un agent chlorurant qui peut être utilisé pour former un dérivé halogéné RCl à partir d'un alcool ROH. L'équation de la réaction s'écrit :
PCl5 + ROH → PCl4OH + RCl
et PCl4OH initialement formé réagit à nouveau avec un autre alcool ou donne l'oxychlorure de phosphore ou trichlorure de phosphoryle POCl3 et HCl.
Réaction avec les acides carboxyliques
PCl5 réagit avec les acides carboxyliques RCOOH pour donner des chlorures d'acides carboxyliques RCOCl. L'équation de la réaction s'écrit :
PCl5 + RCOOH → POCl3 + RCOCl + HCl
Réaction avec les polymères
PCl5 attaque les plastiques et le caoutchouc.
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- PENTACHLORURE DE PHOSPHORE, Fiches internationales de sécurité chimique
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Pentachlorure de phosphore » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Greenwood N.N. & Earnshaw A., Chemistry of the elements, Second edition, Elsevier, 1997.
- Portail de la chimie
