Pentoxyde de diiode
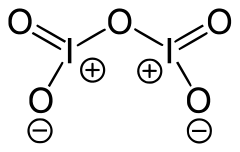
Le pentoxyde de diiode, aussi appelé pentoxyde d'iode, est un composé chimique de formule I2O5. Il s'agit de l'anhydride de l'acide iodique, et il constitue un oxyde d'iode stable.
| Pentoxyde de diiode | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | iodate d'iodyle | |
| Synonymes |
iodopentoxyde |
|
| No CAS | ||
| No ECHA | 100.031.569 | |
| No CE | 234-740-2 | |
| PubChem | 159402 | |
| ChEBI | 29914 | |
| SMILES | ||
| InChI | ||
| Apparence | solide blanc hygroscopique[1] | |
| Propriétés chimiques | ||
| Formule | I2O5 [Isomères] |
|
| Masse molaire[2] | 333,805 9 ± 0,001 6 g/mol I 76,03 %, O 23,97 %, |
|
| Propriétés physiques | ||
| T° fusion | 300 °C (décomposition)[3] | |
| Solubilité | soluble dans l'eau et l'acide nitrique insoluble dans l'éthanol et l'éther |
|
| Masse volumique | 4,980 g·cm-3[1] | |
| Précautions | ||
| SGH[4] | ||
  Danger |
||
| NFPA 704 | ||
| Composés apparentés | ||
| Autres anions | pentafluorure d'iode | |
| Autres composés | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
Il est produit en déshydratant l'acide iodique (un oxoacide) sous un flux d'air chaud[1] :
Réactions
Le pentoxyde de diiode oxyde facilement le monoxyde de carbone CO en dioxyde de carbone CO2, produisant alors du diiode I2 à température ambiante :
Il permet ainsi d'analyser la concentration d'un gaz en monoxyde de carbone. Il forme des sels iodyle [IO2+] en réagissant avec le trioxyde de soufre SO3 et le peroxyde de bis(fluorosulfuryle) S2O6F2 et des sels iodosyle [IO+] en présence d'acide sulfurique concentré.
Notes et références
- (en) Norman Greenwood, Alan Earnshaw, Chemistry of the Elements (2nd ed.), Butterworth-Heinemann, (ISBN 978-0-08-037941-8), p. 851-852
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Pradyot Patnaik, Handbook of Inorganic Chemicals, McGraw-Hill, (ISBN 0-07-049439-8)
- (en) « Diiodine pentaoxide », sur European Chemicals Agency (ECHA) (consulté le )
- Portail de la chimie
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons - Attribution - Partage dans les Mêmes. Des conditions supplémentaires peuvent s'appliquer aux fichiers multimédias.
