Pentoxyde d'azote
Le pentoxyde d'azote, ou pentaoxyde de diazote, est un composé chimique de formule N2O5. Il s'agit d'un solide blanc instable et très oxydant autrefois utilisé dissous dans le chloroforme CHCl3 comme réactif de nitration mais depuis largement remplacé par le tétrafluoroborate de nitronium NO2BF4. N2O5 est une molécule apolaire à l'état gazeux et à l'état liquide, mais ionique à l'état solide :
- N2O5 [NO2+][NO3−].
| Pentoxyde d'azote | |
 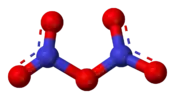 Structure du pentoxyde d'azote. |
|
| Identification | |
|---|---|
| Synonymes |
pentoxyde de diazote |
| No CAS | |
| No ECHA | 100.030.227 |
| No CE | 233-264-2 |
| PubChem | 66242 |
| ChEBI | 29802 |
| SMILES | |
| InChI | |
| Apparence | solide blanchâtre à cristaux incolores |
| Propriétés chimiques | |
| Formule | N2O5 [Isomères] |
| Masse molaire[1] | 108,010 4 ± 0,001 9 g/mol N 25,94 %, O 74,06 %, |
| Propriétés physiques | |
| T° fusion | 30 °C |
| T° ébullition | 47 °C (sublimation) |
| Masse volumique | 1,642 g·cm-3 |
| Précautions | |
| NFPA 704 | |
| Unités du SI et CNTP, sauf indication contraire. | |
Synthèse et propriétés
La première synthèse de N2O5 a été réalisée dans les années 1840 par le chimiste français Henri Sainte-Claire Deville en traitant du nitrate d'argent AgNO3 par du chlore Cl2. On le prépare aujourd'hui en laboratoire en déshydratant de l'acide nitrique HNO3 avec du pentoxyde de phosphore P4O10[2] :
Le pentoxyde d'azote est l'anhydride de l'acide nitrique :
À l'état solide, il se présente comme un solide ionique formé de cations nitronium NO2+ à géométrie linéaire et d'anions nitrate NO3− à géométrie plane. À l'état liquide et à l'état gazeux, en revanche, la molécule N2O5 est apolaire ; c'est également le cas à l'état solide lorsqu'il a été extrait d'un solvant apolaire tel que le tétrachlorométhane CCl4.
Le pentoxyde d'azote a été utilisé comme agent de nitration des aryles :
- N2O5 + Ar–H → HNO3 + Ar–NO2.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) A. F. Holleman, E. Wiberg, « Inorganic Chemistry », Academic Press, San Diego, 2001. (ISBN 0-12-352651-5)
- Portail de la chimie
