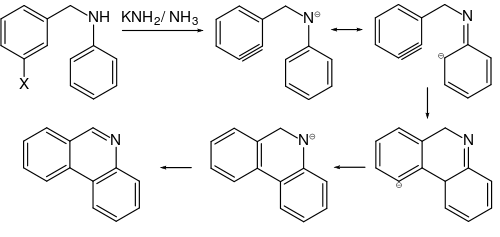
Phénanthridine
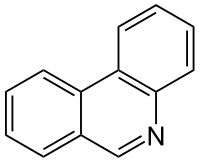
La phénanthridine est un composé organique du groupe des hétérocycles contenant de l'azote. Elle correspond à un phénanthrène substitué par un atome d'azote en position 9. Des dérivés de la phénanthridine sont produits naturellement par exemple par des espèces végétales dans la sous-famille des Amaryllidoideae appartenant à la famille des Amaryllidaceae.
| Phénanthridine | |||
| |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | phénanthridine | ||
| Synonymes |
benzo[c]quinoline |
||
| No CAS | |||
| No ECHA | 100.005.396 | ||
| No CE | 205-934-4 | ||
| PubChem | 9189 | ||
| SMILES | |||
| InChI | |||
| Apparence | poudre cristalline marron clair[1] | ||
| Propriétés chimiques | |||
| Formule | C13H9N [Isomères] |
||
| Masse molaire[2] | 179,217 3 ± 0,011 2 g/mol C 87,12 %, H 5,06 %, N 7,82 %, |
||
| Propriétés physiques | |||
| T° fusion | 104-107 °C[1] | ||
| T° ébullition | 348,9 °C à 760,0 mmHg[3] 349 °C à 1025 hPa[1] |
||
| Masse volumique | eau :7,7 μg·mL[3] | ||
| Précautions | |||
| SGH[1] | |||
  |
|||
| Transport[3] | |||
|
|||
| Composés apparentés | |||
| Isomère(s) | acridine | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
Synthèse
La phénanthridine a été synthétisée pour la première fois en 1889 par Amé Jules Pictet (de) et H. Jan Ankersmit et par pyrolyse dans un tube incandescent de benzalaniline (de), produit de condensation de benzaldéhyde et d'aniline[4].
Dans la réaction de Pictet-Hubert (1899) le composé est formé dans une réaction d'un adduit de 2-aminobiphényl (de)-formaldéhyde (une N-acyl-o-xénylamine) avec du chlorure de zinc à de hautes températures[5]. Les conditions de la réaction de Pictet-Hubert ont été améliorées par Morgan (de) et Walls en 1931, en remplaçant le zinc par l'oxychlorure de phosphore, POCl3 et en utilisant du nitrobenzène comme solvant[6]. Pour cette raison, la réaction est également appelée réaction de Morgan–Walls[7] :
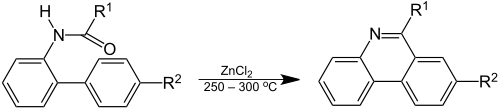 Réaction de Pictet-Hubert
Réaction de Pictet-Hubert
Cette réaction est similaire à la réaction de Bischler-Napieralski (en) et à la réaction de Pictet-Spengler. La production de phénanthridine à partir de phénanthraquinone, N-méthyl carbazole, fluorénonoxime ou phénanthridone est possible[8].
À partir de benzylarylamines halogénées, la phénanthridine et de ses dérivés peuvent être synthétisés via des intermédiaires arynes[9] :
Utilisation
La phénanthridine constitue la structure de base de certains alcaloïdes, par ex. la fagaronine qui est une hydrobenzo[c]phénanthridine, des médicaments, par ex. l'isométamidium et d'autres composés chimiques comme le dihydroéthidium, un marqueur fluorescent.
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Phenanthridin » (voir la liste des auteurs).
- Fiche Sigma-Aldrich du composé Phénanthridine, consultée le 18/01/2011.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- PubChem CID 9189
- Amé Pictet, H. J. Ankersmit, Mittheilung Ueber das Phenanthridin, Justus Liebigs Annalen der Chemie, 1889, vol. 266(1-2), pp. 138-153. DOI:10.1002/jlac.18912660107.
- Amé Pictet, A. Hubert, Mittheilungen Ueber eine neue Synthese der Phenanthridinbasen, Berichte der deutschen chemischen Gesellschaft, 1896, vol. 29(2), pp. 1182–1189. (DOI:10.1002/cber.18960290206).
- Gilbert T. Morgan, Leslie Percy Walls, CCCXXXV.—Researches in the phenanthridine series. Part I. A new synthesis of phenanthridine homologues and derivatives, J. Chem. Soc., 1931, pp. 2447–2456. (DOI:10.1039/JR9310002447).
- Jie Jack Li, Name Reactions in Heterocyclic Chemistry., 1re Ed., 2005. (ISBN 0-471-30215-5).
- C. F. Allen, Lindsey Allen, Richard Allen, The Chemistry of Heterocyclic Compounds, Six Membered Heterocyclic Nitrogen. (ISBN 978-0-470-37851-9).
- S. V. Kessar, [PDF] Some new aspects of benzyne and radical mediated cyclisations., Journal of Chemical Sciences, 1988, vol. 100, no 2–3, pp. 217–222.
- Portail de la chimie