Phénoxybenzène
Le phénoxybenzène ou diphényl éther est un composé organique de formule brute C12H10O constitué de deux cycles benzéniques liés par une liaison éther-oxyde (R-O-R').
| Phénoxybenzène | |
| |
| Identification | |
|---|---|
| Nom UICPA | phénoxybenzène |
| Synonymes |
diphényléther |
| No CAS | |
| No ECHA | 100.002.711 |
| No CE | 202-981-2 |
| PubChem | 7583 |
| SMILES | |
| InChI | |
| Apparence | solide cristallin incolore |
| Propriétés chimiques | |
| Formule | C12H10O [Isomères] |
| Masse molaire[1] | 170,207 2 ± 0,010 6 g/mol C 84,68 %, H 5,92 %, O 9,4 %, |
| Moment dipolaire | 1,17 D [2] |
| Diamètre moléculaire | 0,684 nm [2] |
| Propriétés physiques | |
| T° fusion | 26,9 °C[3] |
| T° ébullition | 258 °C[3] |
| Solubilité | 21 mg·l-1 (eau, 20 °C)[3] |
| Paramètre de solubilité δ | 20,7 J1/2·cm-3/2 (25 °C)[2] |
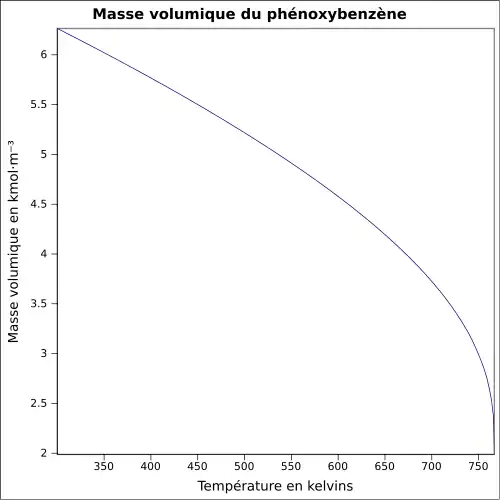
| Masse volumique | 1,07 g·cm-3[3]
|
| T° d'auto-inflammation | 610 °C[3] |
| Point d’éclair | 115 °C[3] |
| Limites d’explosivité dans l’air | 0,8 Vol.-%, 55 g/m3 15 Vol.-%, 1060 g/m3 [3] |
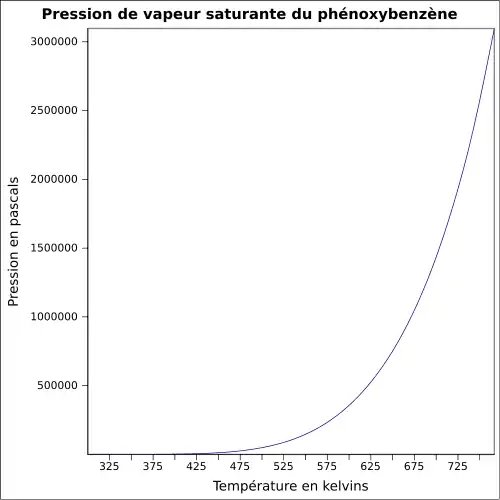
| Pression de vapeur saturante | 0,08 mbar à 20 °C 0,16 mbar à 30 °C 0,52 mbar à 50 °C[3] |
| Point critique | 26,86 °C[5] |
| Point triple | 493,65 °C[6], 31,410 7 bar[7] |
| Thermochimie | |
| ΔfusH° | 17,215 kJ·mol-1 à 26,88 °C[8] |
| ΔvapH° | 66,9 kJ·mol-1± 0,3[9] |
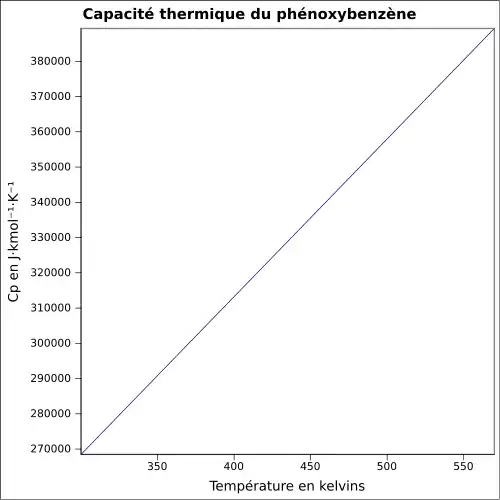
| Cp | |
| Propriétés optiques | |
| Indice de réfraction | 1,5781 [2] |
| Précautions | |
| Directive 67/548/EEC | |
 Xi  N |
|
| Transport[3] | |
| Écotoxicologie | |
| DL50 | 2 450 mg·kg-1 (souris, oral)[10] |
| LogP | 4,21[11] |
| Seuil de l’odorat | bas : 0,1 ppm[12] |
| Unités du SI et CNTP, sauf indication contraire. | |
Production et synthèse
Comme beaucoup d'éther-oxydes, le phénoxybenzène peut être synthétisé par une réaction de type synthèse de Williamson : le phénol en présence de base forte (donc transformé en phénolate) réagit sur le bromobenzène, la réaction étant catalysée par du cuivre.
- PhONa + PhBr → PhOPh + NaBr
Suivant un mécanisme similaire, le phénoxybenzène est un sous-produit important dans l'hydrolyse à haute pression du chlorobenzène pour former du phénol.
Le diphényléther peut également être obtenu par déshydratation intermoléculaire entre deux molécules de phénol. Cette réaction a lieu à 400 °C et en présence de d'oxyde de thorium, ThO2.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- Entrée du numéro CAS « 101-84-8 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 19/10/09 (JavaScript nécessaire)
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- Marsh, K.N., Recommended Reference Materials for the Realization of Physicochemical Properties, Blackwell Sci. Pub., Oxford, 1987
- Ambrose, D.; Broderick, B.E.; Townsend, R., The Critical Temperatures and Pressures of Thirty Organic Compounds, J. Appl. Chem. Biotechnol., 1974, 24, 359.
- Glaser, F.; Ruland, H., Untersuchungsen über dampfdruckkurven und kritische daten einiger technisch wichtiger organischer substanzen, Chem. Ing. Techn., 1957, 29, 772.
- Ginnings, D.C.; Furukawa, G.T., Heat capacity standards for the range 14 to 1200°K,J. Am. Chem. Soc., 1953, 75, 522-527.
- Morawetz, E., Enthalpies of vaporization for a number of aromatic compounds, J. Chem. Thermodyn., 1972, 4, 455.
- National Technical Information Service. Vol. 0TS0518143
- (en) « Phénoxybenzène », sur ChemIDplus
- « Phenyl ether, vapor », sur hazmap.nlm.nih.gov (consulté le )
- Portail de la chimie