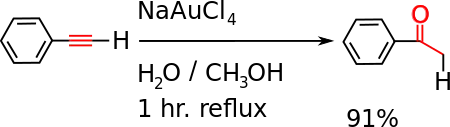Phényléthyne
Le phényléthyne ou phénylacétylène est un hydrocarbure alcynique contenant un groupe phényle. C'est un liquide incolore visqueux. En recherche, il est parfois utilisé comme un analogue de l'acétylène car, étant liquide, il est plus simple à manipuler qu'un gaz comme l'acétylène.
| Phényléthyne | ||
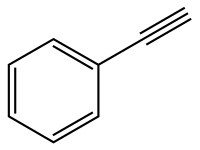
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | éthynylbenzène | |
| Synonymes |
phénylacétylène |
|
| No CAS | ||
| No ECHA | 100.007.861 | |
| No CE | 208-645-1 | |
| PubChem | 10821 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide incolore visqueux | |
| Propriétés chimiques | ||
| Formule | C8H6 [Isomères] |
|
| Masse molaire[1] | 102,133 2 ± 0,006 8 g/mol C 94,08 %, H 5,92 %, |
|
| Moment dipolaire | 0,656 ± 0,005 D[2] | |
| Propriétés physiques | ||
| T° fusion | −44,8 °C[3] | |
| T° ébullition | 142 à 144 °C[3] | |
| Solubilité | ||
| Miscibilité | dans l'éthanol, les éthers[5] | |
| Masse volumique | 0,928 1 g ml−1 à 20 °C[6] | |
| Point d’éclair | 31 °C[6] | |
| Thermochimie | ||
| S0liquide, 1 bar | 221,2 J mol−1 K−1[3] | |
| ΔfH0gaz | 306,6 kJ mol−1[3] | |
| ΔfH0liquide | 284,3 kJ mol−1[3] | |
| ΔfusH° | 9,46 kJ mol−1 à −45,11 °C[3] | |
| Cp | 180,1 J mol−1 K−1 (liquide, 25 °C) 150,41 J mol−1 K−1 (gaz, 126,85 °C)[3] |
|
| PCI | −4 289,9 kJ mol−1[3] | |
| Propriétés optiques | ||
| Indice de réfraction | 1,5470[5] | |
| Précautions | ||
| SGH[7] | ||
   |
||
| NFPA 704[8] | ||
| Écotoxicologie | ||
| DL50 | 100 mg kg−1 (souris, intraveineuse)[4] | |
| LogP | 2,53[4] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Production et synthèse
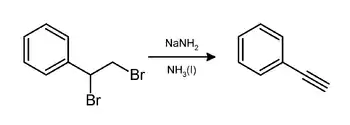
En laboratoire, le phényléthyne peut être préparé par élimination de bromure d'hydrogène (HBr) du dibromostyrène en utilisant de l'amidure de sodium dans l'ammoniac[9] :
Il peut aussi être préparé de la même façon mais en utilisant de l'hydroxyde de potassium en fusion à 200 °C[10].
Caractéristiques physico-chimiques
- Le phényléthyl peut être réduit (hydrogéné) par l'hydrogène en styrène avec le catalyseur de Lindlar.
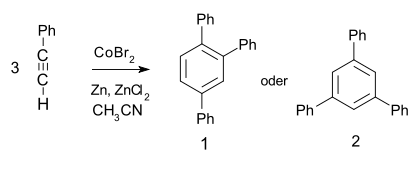
- Il subit une trimérisation catalysée par le cobalt pour former le 1,2,4- (97 %) et le 1,3,5-triphénylbenzène (de)[11] :
- Il subit une réaction d'hydratation catalysée par l'or(III) du tétrachloroaurate de sodium (en) ou le mercure(II) qui donne l'acétophénone.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Phenylacetylene » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50.
- (en) « Phenylacetylene », sur NIST/WebBook (consulté le 22 juillet 2009).
- (en) « Phényléthyne », sur ChemIDplus (consulté le 22 juillet 2009).
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, CRC Press, 2014-2015, 95e éd., 2666 p. (ISBN 978-1-4822-08672), p. 591.
- « PHENYLACETYLENE » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 22 juillet 2009.
- « Fiche phénylacétylène », Merck [PDF] (consulté le ).
- UCB, université du Colorado.
- Kenneth N. Campbell et Barbara K. Campbell, Phenylacetylene, Org. Synth., 1963, vol. 4, p. 763.
- John C. Hessler, Phenylacetylene, Org. Synth., 1941, vol. 1, p. 438.
- Gerhard Hilt, Thomas Vogler, Wilfried Hess et Fabrizio Galbiati, A simple cobalt catalyst system for the efficient and regioselective cyclotrimerisation of alkynes, Chemical Communications, 2005, vol. 2005 (11), p. 1474–1475, DOI:10.1039/b417832g.
- Portail de la chimie
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons - Attribution - Partage dans les Mêmes. Des conditions supplémentaires peuvent s'appliquer aux fichiers multimédias.