Plasmopara viticola
Plasmopara viticola est un pseudochampignon de la famille des Peronosporaceae de la classe des Oomycetes. Il existe sous la forme de spores libres ou de mycélium ne pouvant croître qu'à l'intérieur des tissus de la vigne qu'il parasite. C'est l'agent pathogène du mildiou de la vigne. Il est signalé en Europe pour la première fois en Aquitaine en 1878[1], importé du continent américain.

| Domaine | Eukaryota |
|---|---|
| Règne | Chromalveolata |
| Division | Stramenopiles |
| Embranchement | Oomycota |
| Classe | Oomycetes |
| Ordre | Peronosporales |
| Famille | Peronosporaceae |
| Genre | Plasmopara |
- Botrytis viticola Berk. & M.A. Curtis, (1848)
- Peronospora viticola
(Berk. & M.A. Curtis) de Bary, (1863) - Plasmopara amurensis Prots., (1946)
- Rhysotheca viticola
(Berk. & M.A. Curtis) G.W. Wilson, (1907)
Étymologie et histoire de la nomenclature
Étymologie : le terme Plasmopara se décompose[2] en plasmo- (représentant plasmode « structure à plusieurs noyaux », du latin plasma- « forme, figure » + suffixe -ode « semblable ») et -para forme féminine en latin scientifique de -pare. Le terme viticola emprunté au latin viticola « vigneron ».
Avant 1845, les vignes européennes (Vitis vinifera) ne connaissaient ni oïdium, ni phylloxera et ni non plus de mildiou. En quelques décennies pourtant, ces maladies venues d'Amérique du Nord ravagèrent le vignoble européen : l'oïdium arriva en 1845, le phylloxera en 1861-1863 et le mildiou de la vigne suivit en 1878[3]. Planchon fut le premier à le détecter dans le Sud-Ouest puis on le trouva dans la région de Lyon, en Italie et en Suisse.
L'agent du mildiou de la vigne avait été décrit sous le nom de Botrytis viticola par Berkeley et Curtis en 1848. Mais l'élucidation du mode d'action de ce pathogène fut accomplie par un microbiologiste allemand, Anton de Bary en 1863. Ce grand pionnier de l'étude des champignons avait notamment découvert le cycle de développement sexuel de l'oomycète Phytophthora infestans provoquant le mildiou de la pomme de terre. De Bary décrivit aussi les cycles sexuel et asexuel du mildiou de la vigne[4] et plaça le pathogène responsable sous le genre Peronospora soit avec le nom d'espèce Peronospora viticola (De Bary 1863).
Vingt cinq ans plus tard, Berlese et De Toni (1888) reclassèrent l'agent du mildiou de la vigne dans le genre Plasmopara. Ce dernier produit des sporocystes (ou sporanges) dans lesquels les zoospores diploïdes sont produites, alors que les Peronospora germent par des tubes de germination (conidies).
Enfin, le dernier grand remaniement vient des études de phylogénétique[5] qui ont extrait les oomycètes du règne des champignons (Fungi) pour les placer dans les Bikonta, division des Stramenopiles (ou hétérocontes).
Le mildiou en viticulture
Plasmopara viticola est un endoparasite obligatoire qui se développe uniquement dans les tissus verts de la vigne et en particulier dans le parenchyme des feuilles[6]. Il vit aux dépens des tissus qu'il parasite et qu'il finit par détruire. On est actuellement incapable de le cultiver sur un milieu synthétique[7]. Au cours de son cycle de développement, Plasmopara viticola reste essentiellement sous forme diploïde. S'il est bien capable de fécondation croisée entre filaments mycéliens de type génétique différents[8], les gamètes (haploïdes) restent toujours à l'intérieur de formations mycéliennes, nommées gamétocystes.
P. viticola se caractérise aussi par le fait que les filaments de son mycélium n'ont pas de cloisons, que la paroi est cellulosique (à la différence des Eumycètes qui contiennent de la chitine) et que les zoospores sont biflagellées. Le passage par l'état filamenteux de son mycélium et son hétérotrophie le rapprochent certes des vrais champignons (Eumycètes) mais c'est le résultat d'une convergence évolutive. Son classement phylogénétique le place parmi les Oomycètes, plus proches des algues brunes et des diatomées que des « vrais champignons » Eumycètes[5].
P. viticola est une espèce endémique sur les espèces sauvages de Vitis d'Amérique du Nord[4]. Aussi les différentes espèces nord-américaines sont-elles devenues plus ou moins résistantes : Vitis rupestris est moyennement résistante et Vitis rotundifolia (ou muscadine) est résistante[9]. Par contre, la vigne européenne (Vitis vinifera cultivée) qui a longtemps évolué hors de tout contact avec ce pathogène, est très sensible.
Cycles de développement de P. viticola
Le pseudochampignon P. viticola se manifeste sous trois formes différentes au cours de son cycle de développement. Il passe par les stades oospores, zoospores et mycélium et leurs fructifications respectives (ou sporocystes). Les spores possèdent leur propre réserve énergétique interne. L'oospore est un œuf, obtenu par croisement "sexué" entre deux thalles (croisement hétérothallique). La zoospore est une spore munie de deux flagelles lui servant à se mouvoir dans le mince film d'eau à la surface des tissus végétaux. Ces deux types de spores puisent dans leur propre réserve énergétique pour croître ou se déplacer. Par contre, le mycélium se développe obligatoirement à l'intérieur des tissus de la vigne. Il se nourrit uniquement aux dépens des cellules végétales de la vigne avec pour conséquence des lésions tissulaires pouvant occasionner éventuellement des pertes de récolte importantes.

Le développement de Plasmopara viticola se fait suivant deux cycles imbriqués[4] :
- un cycle sexué, long, passant par la forme oospore dormante, résistante au froid, puis au printemps, la germination donnant des zoospores, allant infecter les tissus de la vigne par un mycélium parasitaire responsable de l'infection primaire, pour se terminer à l'automne par la formation d'un nouvel œuf, bien protégé par des parois épaisses et capable de survivre l'hiver en l'absence de végétation ;
- un cycle court et rapide, passant directement du mycélium aux zoospores, capables de propager des infections secondaires lors de la période végétative, par multiplication clonale.
Dans une section ci-dessous, chaque étape de ces deux cycles de reproduction est détaillée et illustrée plus abondamment (voir cadre jaune).
Cycle de P. viticola et symptômes du mildiou
Les oospores sont des œufs formées à l'intérieur des tissus de la vigne au cours de l'automne. Après la chute des feuilles, ils survivent dans la litière au sol.
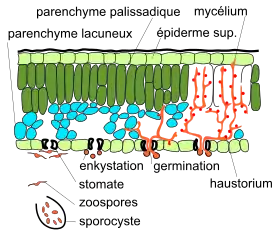
Au printemps, lorsque la température dépasse le 12 °C, les oospores germent et donnent naissance à de nombreuses zoospores. À l'occasion de pluies printanières, les zoospores sont projetées par les éclaboussures d'eau sur les organes aériens de la vigne les plus proches du sol[7]. Les zoospores migrent alors vers les stomates, perdent leurs flagelles et émettent un promycélium qui pénètre le limbe. Celui-ci produit de nombreux hyphes mycéliens qui s'infiltrent entre les cellules, envahissent complètement une zone de tissus et provoquent une lésion locale.

Sur les feuilles, apparaissent deux formes de lésions :
- a) des taches plus ou moins circulaires, translucides à huileuses, appelées « taches d'huile » qui assez rapidement jaunissent puis se nécrosent. Au revers de la feuille, un feutrage blanchâtre se manifeste rapidement. Il correspond aux fructifications (ou sporocystophores) émis à l'extérieur par le mycélium infectant. De nombreuses zoospores sont libérées et vont propager l'infection ;
- b) des taches d'extension limitées, de forme polygonale car limitées par les nervures, plus ou moins chlorotiques à nécrotiques[7]. Elles apparaissent en général à l'automne sur les feuilles âgées. On nomme le faciès « mildiou à mosaïque ».
Sur les jeunes rameaux, apparaissent des lésions superficielles longitudinales, de couleur brune, pouvant provoquer une déformation de la tige. Des fructifications de P. viticola peuvent aussi sortir du rameau.
Les inflorescences et les baies du raisin sont aussi sensibles au mildiou. Des sporocystophores peuvent aussi s'y développer. Les baies affectées plus tardivement présentent des taches brunes à noirâtres, déprimées (en « coup de pouce »), non fructifères. On parle dans ce cas de « rot brun ».
Ainsi au printemps, une oospore de l'année passée, germe et donne de nombreuses zoospores qui vont contaminer les tissus de la vigne. Lors de cette infection primaire, le mycélium dense qui se développe à l'intérieur des tissus, produit des suçoirs (ou hausterium) qui vident les cellules de l'hôte de leurs nutriments et de leur eau. Le mildiou se développe toujours à partir de ces foyers primaires d'infection. Ces foyers primaires apparaissent pratiquement toujours aux mêmes endroits dans un vignoble et ont une extension limitée[10].
De ces lésions naissent des fructifications extérieures, nommées des sporocystophores (ou sporangiophores, apparaissant sous forme de feutrage blanc) qui à maturité, libèrent de nombreuses zoospores. Celles-ci par le même processus de dispersion-pénétration envahissent des zones saines des tissus et réalisent des infections secondaires.
La température et l'humidité affectent le développement de P. viticola. Depuis longtemps, les viticulteurs ont observé qu'il apprécie les périodes pluvieuses et les températures douces. En prévention, il est recommandé d'aérer la zone fructifère et d'empêcher la formation des mouillères dues à un excès d’eau dans la parcelle[11].
Biologie des cycles de reproduction sexuée et non sexuée
Reprenons plus précisément, le cycle de développement de P. viticola. Il se décompose en :
- i) une reproduction sexuée[12] (par croisement hétérothallique), à l'automne au moment de la sénescence des feuilles et destinée à perpétuer l'espèce durant la saison froide jusqu'au retour de la végétation de la vigne ;
- ii) une reproduction asexuée (ou clonale) durant la saison végétative, destinée à disséminer rapidement l'épidémie.
| Les cycles de reproduction de Plasmopara viticola | |
|---|---|
| 1. Maturation des oospores : les oospores sont des œufs diploïdes formés à l'automne dans les tissus mildiousés qui vont se maintenir essentiellement à l'intérieur des feuilles mortes ainsi que sur le sol, durant tout l'hiver. Sur le sol, le stock d'oospores peut varier de 100 à 30 000 spores par mètre carré[13].
Enveloppées dans une double paroi robuste[14], les oospores sont les seules structures de P. viticola capables de survivre à des conditions hivernales difficiles voire extrêmes, car elles peuvent supporter des températures de −20 °C. Les oospores commencent à être matures en novembre et le froid prolongera leur aptitude à germer pendant plusieurs mois. |
Oospore |
| 2. Germination de l'oospore : au printemps suivant, lorsque le sol et l'atmosphère sont très humides et que la température atteint 12−13 °C, une partie des oospores sortent de leur dormance. L'oospore commence par produire des dizaines de noyaux diploïdes (obtenus par mitose) avant qu'émerge un tube germinatif[12]. Les noyaux migrent alors dans le tube jusque dans une ou plusieurs cavités piriformes, nommées sporocystes, (ou macrosporanges ou sporanges[N 1], ou macroconidies).
Le taux de germination des oospores fluctue au cours du temps et à partir de mars, on observe un effet positif de la pluie sur le taux de germination[15]. Les oospores conservent même leur aptitude à germer plusieurs années[16]. |

Germination de l'oospore |
| 3. Libération et dispersion des zoospores : les noyaux se multiplient par division mitotique, si bien que chaque sporocyste peut libérer de 60 à 200 spores mononuclées, appelées zoospores. Les éclaboussures de pluie et de terre occasionnées par les fortes précipitations dispersent les sporocystes et les zoospores sur les tissus de la vigne.
Les zoospores se déplacent grâce à leurs deux flagelles dans le mince film d'eau à la face inférieure des feuilles et sur les baies, pour trouver un stomate dans lequel pénétrer. Les zoospores déposées sur une surface qui sèche rapidement, ne survivent pas. Contrairement aux oospores, leur durée de vie est très courte. |

Libération des zoospores par un sporocyste |
| 4. Germination du zoospore : quatre à cinq zoospores s’agglomèrent autour d'un stomate ouvert et perdent leurs flagelles. Elles émettent un tube germinatif (ou siphon infestant ou promycélium) qui pénètre le limbe de la feuille et conduit à la formation d'une vésicule sous-stomatique dans la cavité sous-stomatique[6].
5. Infection primaire : le cytoplasme des zoospores est transmis à cette vésicule qui rapidement va émettre un haustorium (suçoir) primaire vers une cellule hôte. Cet inoculum primaire (ou infection primaire) marque le début du cycle agamique. Les premiers symptômes se manifestent une dizaine de jours après la contamination[7], ce qui correspond à la période d'incubation. Un mycélium se développe dans les espaces intercellulaires et s'alimente par des suçoirs (haustoria) qui pénètrent les cellules du parenchyme et de l'épiderme. Rapidement, ces haustoria secondaires pénètrent la paroi des cellules végétales pour pomper l'eau et les nutriments qu'elles contiennent. Les tissus lacuneux sont rapidement colonisés. Un corps sous-stomatal se développe et décolle le tissu épidermique du tissu parenchymateux, ce qui donne le symptôme de la « tache d'huile », une tache translucide apparaissant 4 à 5 jours après le début de l'infection. Le jaunissement de la feuille en raison de la perte de pigment chlorophyllien (du parenchyme palissadique) peut apparaître à partir du huitième jour après le début de l'infection. Outre les infections primaires de début d’épidémie, Gobbin et al[17] ont montré que les infections primaires se prolongeaient tout au long de l’épidémie, à n'importe quel moment entre mai et août. |
4. Germination de la zoospore. La nage de la zoospore jusqu'au stomate, la germination et la pénétration[4] se fait en 3 h à 20 °C. 5. Infection primaire : développement du mycélium |
À cette étape, deux voies de reproduction s'ouvrent alors :
- 6a) une reproduction asexuée qui contribue à propager l'infection : des sporocystophores arborescents sont formés et sortent par les stomates. Ils vont libérer à l'extérieur des zoospores qui vont être à l'origine d'infections secondaires.
- 6b) ou à l'automne, au moment de la sénescence des feuilles, une reproduction sexuée pour assurer la perpétuation de l'espèce.
| 6a. Reproduction asexuée : | |
|---|---|
| 6a.1. Sporulation : des sporocystophores (sporangiophores) apparaissent par l'ouverture des stomates. Ce sont des arbuscules ramifiés de plusieurs centaines de microns qui se manifestent sous la forme visible d'un feutrage blanc sur la face inférieure des feuilles (et sur les baies). Les ramifications portent à leurs extrémités des sporocystes (sporanges) hyalins dans lesquels migrent des noyaux.
6a.2. Germination des sporocystes : après division mitotique des noyaux, les sporocystes libèrent 3 à 8 zoospores dans l'eau libre, 5 à 10 jours plus tard. Les conditions requises sont une température t > 13 °C (et température optimale de 19 °C) et une humidité de 98 %. 6a.3. Le cycle de reproduction asexuée est bouclé par une dispersion et une germination des zoospores dans un stomate (étape 4) et une infection (étape 5) qui cette fois est dite « secondaire ». La sporulation marque le début d'un cycle secondaire : les zoospores sont dispersées par le vent pour atteindre et contaminer de nouvelles feuilles. |
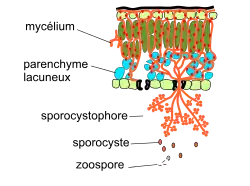
Sporulation : sortie de sporocystophores portant des sporocystes qui libèrent des zoospores. La sporulation se fait en 7 heures, dans le noir (elle est inhibée par la lumière[4]). Les zoospores se dispersent et provoquent une infection secondaire |
Les travaux de Gobbin et als[17] (2008) ont montré que les contaminations secondaires par ce cycle asexué sont moins importantes que ce que l'on pensait antérieurement.
| 6b. Reproduction sexuée : | |
|---|---|
| 6b.1. Méiose : durant l'automne, au moment de la sénescence des feuilles, les filaments du mycélium de P. viticola forment des organes sexués (ou gamétocystes) dont la totalité de leur contenu évolue en gamètes par méiose. Le gamétocyste mâle[N 2],[8] (ou spermatocyste ou anthéridie) contient les gamètes mâles qui sont en fait réduits à un noyau haploïde et le gamétocyste femelle (ou oogone) contient des oosphères renfermant un noyau femelle haploïde et des réserves. Deux gamétocystes provenant de mycéliums génétiquement différents s'accolent alors l'un à l'autre (croisement hétérothallique, Wong et al.[8]).
6b.2 Des tubes copulateurs partent des spermatocystes et pénètrent l'oogone pour permettre aux noyaux mâles d'aller féconder les gamètes femelles. Il n'y a pas de gamètes libérés à l'extérieur puisque les fécondations se produisent dans l'oogone. 6b.3 Formation des oospores : la fécondation se fait à l'intérieur de l'oogone. Celle-ci produit un zygote ou oospore. 6b.4 Libération des oospores. Cette étape ferme le cycle sexuel par un retour à l'étape 1. Même sous les conditions de température et d'humidité optimales, les oospores ne germent pas avant janvier-février. Le cycle de la reproduction sexuée se fait sur une année alors que celui de la reproduction asexuée se fait en un temps beaucoup plus court durant la saison végétative. Ce mode de reproduction appelé oogamie siphonogamme est caractéristique des Oomycètes. |

|
Protection contre le mildiou de la vigne
La lutte contre le mildiou s'organise principalement par des mesures préventives. Car s'il est possible de stopper une attaque, les dégâts une fois occasionnés sur les inflorescences et les grappes, sont par contre irrémédiables.
Quelques précautions sont importantes pour éviter l'installation de foyers primaires pouvant provenir d'oospores ayant passé l'hiver au niveau du sol et qui après germination produisent des zoospores contaminantes[10] :
- éviter l'accumulation d'eau dans les creux ou en bout de rang ; cela suppose d'assainir le terrain par drainage avant la plantation et de faciliter chaque année, l'écoulement des eaux de ruissellement ;
- éliminer les gourmands à la base du tronc ;
- effectuer des relevages précoces.
La pulvérisation de fongicides anti-mildiou se fait d'abord de manière préventive sur les organes sains pour éviter leur infection. Pour décider du moment opportun et éviter des traitements inutiles, le viticulteur peut s'aider de systèmes d'aide à la décision ou prendre conseil auprès de techniciens. Empiriquement, on sait que le risque d'une germination précoce des oospores correspond à une période automne-hiver-printemps douce et pluvieuse. Une autre règle empirique[18] dites des "3-10" indique qu'une infection primaire est importante si :
- la température dépasse les 10 °C ;
- les jeunes pousses font plus de 10 cm de long et ;
- il est tombé au moins 10 mm de pluie en 24-48 heures.
Pendant la période de croissance de la vigne, il faut ensuite procéder à des pulvérisations régulières de fongicides en fonction de la vitesse de croissance de la végétation, de la fréquence des pluies, de la température et de la pression parasitaire[13]. Depuis deux décennies, de nombreux modèles d'aide à la décision ont été proposés. Le modèle de Caffi et al. (2009)[18] est un modèle systémique qui intègre l'influence de la pluviométrie, de l'humidité relative, de la température sur la maturation d'une cohorte d'œufs d'hiver, leur germination, leur production de sporocystes, et la libération et la dispersion des zoospores. Le modèle "Potentiel Systèmes" calcule, en fonction des données météorologiques recueillies sur différents secteurs du vignoble, des variables représentant principalement la maturité des œufs d'hiver, la pression exercée par diverses maladies et les dates de contamination.
Le traitement fongicide traditionnel mis au point à la fin du XIXe siècle était la bouillie bordelaise. Ce fut le seul produit utilisé jusqu'au milieu du XXe siècle mais il fut ensuite rapidement supplanté par les fongicides de synthèse. Actuellement, une pléthore de fongicides anti-mildiou sont proposés. On peut les classer en trois grandes classes : les produits de contacts, les produits pénétrants et les systémiques.
Notes
- Le terme anglais de sporangium correspond en français, à sporange pour les embryophytes, et à sporocyste pour les fungi et pseudofungi.
- Pour simplifier, nous emploierons les termes de mâle et femelle, là où il faudrait parler de type de croisement P1 et P2, en raison de l'hétérothallisme, voir Wong et al., 2001.
Références
- Jacques Barnouin, Ivan Sache et al. (préf. Marion Guillou), Les maladies émergentes : Épidémiologie chez le végétal, l'animal et l'homme, Versailles, Quæ, coll. « Synthèses », , 444 p. (ISBN 978-2-7592-0510-3, ISSN 1777-4624, lire en ligne), I. Facettes et complexité de l'émergence, chap. 2 (« Les maladies émergentes affectant les végétaux »), p. 25, accès libre.
- Entrée "Plasmopara" sur le CNRTL.
- W. G. Farlow, American Grape Mildew in Europe, Botanical Gazette, (lire en ligne).
- Cesare GESSLER, Ilaria PERTOT, Michele PERAZZOLI, « Plasmopara viticola: a review of knowledge on downy mildew of grapevine and effective disease management », Phytopathol. Mediterr., vol. 50, , p. 3-44.
- François Lutzoni, « Assembling the fungal tree of life: progress, classification, and evolution of subcellular traits », American Journal of Botany, vol. 91, no 10, , p. 1446-1480 (ISSN 0002-9122 et 1537-2197, DOI 10.3732/ajb.91.10.1446, lire en ligne, consulté le ).
- Sébastien Bellow, Étude des composés phénoliques impliqués dans la réponse des feuilles de vigne au mildiou, Thèse, Université de Paris-sud, UFR des Sciences, .
- INRA.
- F. P. Wong, « Heterothallism in Plasmopara viticola », Plant Pathology, vol. 50, no 4, , p. 427–432 (ISSN 1365-3059, DOI 10.1046/j.1365-3059.2001.00573.x, lire en ligne, consulté le ).
- G.H. Dai, « Histochemical studies on the interaction between three species of grapevine, Vitis vinifera, V. rupestris and V. rotundifolia and the downy mildew fungus, Plasmopara viticola », Physiological and Molecular Plant Pathology, vol. 46, no 3, , p. 177-188 (ISSN 0885-5765, DOI 10.1006/pmpp.1995.1014, lire en ligne, consulté le ).
- Alain Reynier, Manuel de viticulture : guide technique du viticulteur, Paris, Éd. Tec & doc, , 592 p. (ISBN 978-2-7430-1347-9, lire en ligne).
- « Mildiou vigne : Bayer-Agri, comment contrôler le mildiou de la vigne », sur www.bayer-agri.fr (consulté le ).
- Santella Burruano, « The life-cycle of Plasmopara viticola, cause of downy mildew of vine », Mycologist, vol. 14, no 4, , p. 179-182 (ISSN 0269-915X, DOI 10.1016/S0269-915X(00)80040-3, lire en ligne, consulté le ).
- V. Rossi, S. Giosuè and T. Caffi, « MODELLING THE DYNAMICS OF INFECTIONS CAUSED BY SEXUAL AND ASEXUAL SPORES DURING PLASMOPARA VITICOLA EPIDEMIC », Journal of Plant Pathology, vol. 91, no 3, , p. 615-627.
- Annamaria Vercesi, « A cytological and ultrastructural study on the maturation and germination of oospores of Plasmopara viticola from overwintering vine leaves », Mycological Research, vol. 103, no 2, , p. 193-202 (ISSN 0953-7562, DOI 10.1017/S095375629800700X, lire en ligne, consulté le ).
- Annamaria Vercesi, « A new approach to modelling the dynamics of oospore germination in Plasmopara viticola », European Journal of Plant Pathology, vol. 128, no 1, , p. 113-126 (ISSN 0929-1873 et 1573-8469, DOI 10.1007/s10658-010-9635-8, lire en ligne, consulté le ).
- Tito Caffi, V. Rossi, M. Lusitani, « Long-term survival of Plasmopara viticola oospores », OBC/WPRS Bulletin, , p. 111-114.
- D. Gobbin, M. Jermini, B. Loskill, I. Pertot, M. Raynal et C. Gessler, « Contaminations primaires de Plasmopara viticola : un rôle sous-estimé », Le Progrès agricole et viticole, Actualités phytosanitaires, vol. 125, no 20, , p. 545-548 (lire en ligne).
- T. Caffi, V. Rossi, R. Bugiani, F. Spanna, L. Flamini, A. Cossu and C. Nigro, « A MODEL PREDICTING PRIMARY INFECTIONS OF PLASMOPARA VITICOLA IN DIFFERENT GRAPEVINE-GROWING AREAS OF ITALY », Journal of Plant Pathology, vol. 91, no 3, , p. 535-548 (lire en ligne).
Voir aussi
Bibliographie
- Jermini, M., Blaise, P., & Gessler, C. (2015). Quantitative effect of leaf damage caused by downy mildew (Plasmopara viticola) on growth and yield quality of grapevine'Merlot'(Vitis vinifera). VITIS-Journal of Grapevine Research, 49(2), 77.
Liens externes
- (en) Référence Index Fungorum : Plasmopara viticola (+ MycoBank)
- (fr) Référence Catalogue of Life : Plasmopara viticola (Berk. & M.A. Curtis) Berl. & De Toni 1888
- (en) Référence NCBI : Plasmopara viticola (taxons inclus)
- Index Fungorum
- USDA ARS Fungal Database
- DOI:10.1111/j.1364-3703.2006.00357.x
- Portail de l’agriculture et l’agronomie
- Portail de la vigne et du vin
- Portail de la mycologie
- Portail de la protection des cultures