Polyphosphazène
Les polyphospahènes sont une classe de polymères hybrides organiques et inorganiques pouvant présenter une grande variété d'architectures partageant des chaînes du type –N=P–N=P–N=P–[1]. Dans pratiquement tous ces matériaux, deux groupes organiques sont liés à chaque atome de phosphore. Il existe des polymères linéaires, dont la formule générique peut s'écrire N=PR1R2, où R1 et R2 sont des substituants organiques, ainsi que d'autres architectures, telles que des polymères cyclolinéaires et cyclomatriciels, dans lesquels de petits cycles de phosphazène sont liés par des chaînes organiques. On trouve par ailleurs des copolymères à blocs, en étoile (en), dendritiques (en), ou en peigne. On connaît plus de 700 polyphosphazènes différents, identifiées par leurs groupes latéraux et leur architecture macromoléculaire. Un grand nombre de ces composés ont été synthétisés et étudiés pour la première fois dans les années 1960 par l'équipe du chimiste britannique Harry Allcock (en)[1], qui les appelait alors « composés phosphonitriliques »[2],[3].
Synthèse
Le mode de synthèse dépend du type de polyphosphazène considéré. La méthode la plus employée pour produire des polymères linéaires repose sur un procédé en deux étapes. La première étape consiste à chauffer, à environ 250 °C dans un système fermé, une petite molécule de phosphazène cyclique appelée hexachlorocyclotriphosphazène, ou plus simplement hexachlorophosphazène, et de formule (NPCl2)3 : cela conduit à polymériser ce composé pour former une longue chaîne linéaire de poly(dichlorophosphazène) (NPCl2)n d'au moins 15 000 unités. La seconde étape du procédé consiste à substituer les atomes de chlore de cette chaîne par des groupes organiques à l'aide de réactions faisant intervenir des alcoolates, des phénols, des amines ou des organométalliques. Comme on peut utiliser un grand nombre de réactifs différents selon différentes combinaisons, il est possible de produire une grande variété de structures présentant des propriétés différentes. Il est également possible de faire intervenir des réactions de condensation pour obtenir le poly(dichlorophosphazène) intermédiaire[4].
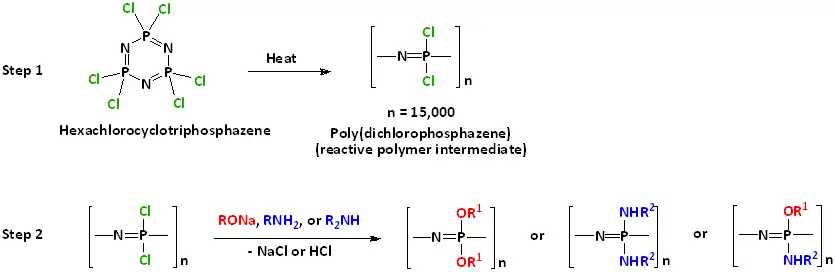
Il est également possible de procéder par polymérisation vivante à propagation cationique permettant la formation de copolymères à blocs, en étoile (en), dendritiques (en) ou en peigne[5],[6]. D'autres méthodes de synthèse font intervenir des réactions de condensation de phosphoranimines substituées avec des groupes organiques[7],[8],[9],[10].
Les polymères de type cyclomatriciels liant des cycles phosphazène entre eux font appel à des réactifs organiques difonctionnels pour substituer les atomes de chlore de l'hexachlorophosphazène (NPCl2)3 ou à l'introduction de substituants vinyle –CH=CH2 ou allyle –CH2–CH=CH2 par polymérisation radicalaire[11]. De tels polymères peuvent être utilisés comme revêtements ou polymères thermodurcissables, intéressants du point de vue de leur stabilité thermique.
Propriétés et applications
Plus de 700 hauts polymères linéaires sont connus, dont les propriétés sont déterminées à la fois par les substituants sur les atomes de phosphore et par la flexibilité de la chaîne –N=P–N=P–. Parmi les propriétés intéressantes de ces composés, on peut noter la résistance aux radiations, un indice de réfraction élevé, la transparence aux ultraviolets et à la lumière visible, la résistance au feu. Les substituants confèrent des propriétés supplémentaires telles que leur couleur, leur nature hydrophile ou hydrophobe, leur capacité à être biodégradables, ou encore leurs propriétés de transporteurs d'ions.

Thermoplastiques
Les premiers poly(organophosphazène)s stables étudiés avaient comme substituants des groupes trifluorométhoxyle (en) –OCF3, phénoxyle –OC6H6, méthoxyle –OCH3, éthoxyle –OCH2CH3 et divers groupes amine[2],[3]. Parmi ces premiers composés, le poly[bis(trifluoroethoxyphosphazene)] [NP(OCH2CF3)2]n a fait l'objet de nombreuses recherches en raison de son taux de cristallinité, de son hydrophobie, de sa biocompatibilité, de sa résistance au feu, sa résistance aux radiations et la facilité avec laquelle il peut être produit en films, microfibres et nanofibres.
Élastomères
La première utilisation commerciale à grande échelle des polyphosphazènes a été dans le domaine des élastomères de haute technologie, l'exemple typique combinant des substituants trifluoroéthoxyle et des groupes fluoro-alcoxyle à plus longue chaîne[12],[13],[14]. Le mélange de deux substituants réduit le taux de cristallinité par rapport aux polymères mono-substituant, ce qui améliore leur flexibilité et leur élasticité intrinsèques. Il est possible d'atteindre des températures de transition vitreuse aussi basses que −60 °C. Leur résistance aux huiles et leur hydrophobie en font des matériaux utiles en construction automobile et dans le secteur aéronautique et spatial. Ils ont également été proposés pour des applications biomédicales.
D'autres substituants, comme des alcoxyles non fluorés ou des éthers d'oligo-alkyles, donnent des élastomères hydrophiles ou hydrophobes avec des transitions vitreuses s'étalant de −100 à 100 °C. Des élastomères ayant deux groupes aryloxyle différents sont été développés pour des applications nécessitant de la résistance au feu ainsi que pour l'isolation thermique et sonore.
Électrolytes en polymères
Les polyphosphazènes linéaires avec des substituants oligo(éthylène glycol) forment des gommes qui sont de bons solvants pour des sels comme le triflate de lithium CF3SO3Li. Ces solutions fonctionnent comme des électrolytes pour le transport d'ions de lithium et ont été utilisées dans les accumulateurs électriques résistants au feu[15],[16],[17]. Ces polymères sont également intéressants en vue de développer des cellules solaires à pigments photosensibles[18]. D'autres polyphosphazènes à substituants sulfonate d'aryloxyle sont des conducteurs de protons intéressants en vue de développer des piles à combustible à membrane à échange de protons[19].
Notes et références
- (en) H. R. Allcock et R. L. Kugel, « Synthesis of High Polymeric Alkoxy- and Aryloxyphosphonitriles », Journal of the American Chemical Society, vol. 87, no 18, , p. 4216-4217 (DOI 10.1021/ja01096a056, lire en ligne)
- (en) H. R. Allcock, R. L. Kugel et K. J. Valan, « Phosphonitrilic Compounds. VI. High Molecular Weight Poly(alkoxy- and aryloxyphosphazenes) », Inorganic Chemistry, vol. 5, no 10, , p. 1709-1715 (DOI 10.1021/ic50044a016, lire en ligne)
- (en) H. R. Allcock et R. L. Kugel, « Phosphonitrilic Compounds. VII. High Molecular Weight Poly(diaminophosphazenes) », Inorganic Chemistry, vol. 5, no 10, , p. 1716-1718 (DOI 10.1021/ic50044a017, lire en ligne)
- (en) Roger De Jaeger et Mario Gleria, Synthesis and Characterization of Poly(organophosphazenes), Nova Science Publishers, New York, 2004. (ISBN 9781594540240)
- (en) Harry R. Allcock, Chester A. Crane, Christopher T. Morrissey, James M. Nelson, Scott D. Reeves, Charles H. Honeyman et Ian Manners, « "Living" Cationic Polymerization of Phosphoranimines as an Ambient Temperature Route to Polyphosphazenes with Controlled Molecular Weights », Macromolecules, vol. 29, no 24, , p. 7740-7747 (DOI 10.1021/ma960876j, Bibcode 1996MaMol..29.7740A, lire en ligne)
- (en) Charles H. Honeyman, Ian Manners, Christopher T. Morrissey et Harry R. Allcock, « Ambient Temperature Synthesis of Poly(dichlorophosphazene) with Molecular Weight Control », Journal of the American Chemical Society, vol. 117, no 26, , p. 7035-7036 (DOI 10.1021/ja00131a040, lire en ligne)
- (en) Patty Wisian-Neilson et Robert H. Neilson, « Poly(dimethylphosphazene), (Me2PN)n », Journal of the American Chemical Society, vol. 102, no 8, , p. 2848-2849 (DOI 10.1021/ja00528a060, lire en ligne)
- (en) Robert H. Neilson et Patty Wisian-Neilson, « Poly(alkyl/arylphosphazenes) and their precursors », Chemical Reviews, vol. 88, no 3, , p. 541-562 (DOI 10.1021/cr00085a005, lire en ligne)
- (en) Robert A. Montague et Krzysztof Matyjaszewski, « Synthesis of poly[bis(trifluoroethoxy)phosphazene] under mild conditions using a fluoride initiator », Journal of the American Chemical Society, vol. 112, no 18, , p. 6721-6723 (DOI 10.1021/ja00174a047, lire en ligne)
- (en) Krzysztof Matyjaszewski, Mary K. Moore, and Michael L. White, « Synthesis of polyphosphazene block copolymers bearing alkoxyethoxy and trifluoroethoxy groups », Macromolecules, vol. 26, no 25, , p. 6741-6748 (DOI 10.1021/ma00077a008, lire en ligne)
- (en) Christopher W. Allen, Jonathan C. Shaw, and Douglas E. Brown, « Organophosphazenes. 22. Copolymerization of ((.alpha.-methylethenyl)phenyl)pentafluorocyclotriphosphazenes with styrene and methyl methacrylate », Macromolecules, vol. 21, no 9, , p. 2653-2657 (DOI 10.1021/ma00187a001, Bibcode 1988MaMol..21.2653A, lire en ligne)
- (en) Selwyn H. Rose, « Synthesis of phosphonitrilic fluoroelastomers », Journal of Polymer Science Part B: Polymer Letters, vol. 6, no 12, , p. 837-839 (DOI 10.1002/pol.1968.110061203, Bibcode 1968JPoSL...6..837R, lire en ligne)
- (en) Robert E. Singler, Nathaniel S. Schneider et Gary L. Hagnauer, « Polyphosphazenes: Synthesis—properties—applications », Polymer Engineering and Science, vol. 15, no 5, , p. 321-338 (DOI 10.1002/pen.760150502, lire en ligne)
- (en) D. P. Tate, « Polyphosphazene elastomers », Journal of Polymer Science: Polymer Symposia, vol. 48, no 1, , p. 33-45 (DOI 10.1002/polc.5070480106, lire en ligne)
- (en) Peter M. Blonsky, D. F. Shriver, Paul Austin et H. R. Allcock, « Polyphosphazene solid electrolytes », Journal of the American Chemical Society, vol. 106, no 22, , p. 6854-6855 (DOI 10.1021/ja00334a071, lire en ligne)
- (en) Harry R. Allcock, Stephen J. M. O'Connor, David L. Olmeijer, Mark E. Napierala et Charles G. Cameron, « Polyphosphazenes Bearing Branched and Linear Oligoethyleneoxy Side Groups as Solid Solvents for Ionic Conduction », Macromolecules, vol. 29, no 23, , p. 7544-7552 (DOI 10.1021/ma960592z, Bibcode 1996MaMol..29.7544A, lire en ligne)
- (en) Shih-To Fei, Harry R. Allcock, « Methoxyethoxyethoxyphosphazenes as ionic conductive fire retardant additives for lithium battery systems », Journal of Power Sources, vol. 195, no 7, , p. 2082-2088 (DOI 10.1016/j.jpowsour.2009.09.043, lire en ligne)
- (en) Shih-To Fei, Seung-Hyun Anna Lee, Sean M. Pursel, James Basham, Andrew Hess, Craig A. Grimes, Mark W. Horn, Thomas E. Mallouk et Harry R. Allcock, « Electrolyte infiltration in phosphazene-based dye-sensitized solar cells », Journal of Power Sources, vol. 196, no 11, , p. 5223-5230 (DOI 10.1016/j.jpowsour.2011.01.052, Bibcode 2011JPS...196.5223F, lire en ligne)
- (en) Hao Tang et Peter N. Pintauro, « Polyphosphazene membranes. IV. Polymer morphology and proton conductivity in sulfonated poly[bis(3‐methylphenoxy)phosphazene] films », Journal of Applied Polymer, vol. 79, no 1, , p. 49-59 (DOI 10.1002/1097-4628(20010103)79:1<49::AID-APP60>3.0.CO;2-J, lire en ligne)
- Portail de la chimie