Monilophyta
Les Monilophyta, en français Monilophytes, sont un clade de plantes vasculaires qui comprend les fougères (Ptéridophytes avec mégaphiles ou Pterophyta) et les familles des Psilotaceae et des Equisetaceae. Il doit son nom au fait que dans une section transversale de la tige (stèle), on trouve des lobes de protoxyle rappelant un collier nacré moniliforme. Le nom de Monilophyta a été proposé pour la première fois par Kenrick et Crane en 1997 sous le nom de « infra-division des Moniloformopses ». Aujourd'hui, le nom de Monilophyta est préféré. Les Polypodiophytina ont également été suggérées comme une sous-division des Tracheophyta.
| Règne | Plantae |
|---|---|
| Sous-règne | Viridaeplantae |
| Infra-règne | Streptophyta |
| Classe | Equisetopsida |
- Polypodiopsida Cronquist, Takht. & W.Zimm., 1966[1]
Morphologie
Comme le clade des Monilophyta a été convenu récemment, de nombreux caractères morphologiques du groupe n'ont pas encore été révisés, ce qui nécessite une réinterprétation à la lumière de la nouvelle phylogénie. Génétiquement, le groupe se caractérise par une insertion de 9 nucléotides dans le gène du plastide RPS4. Les caractères morphologiques dans lesquels ils diffèrent du reste des plantes vasculaires acceptées aujourd'hui sont les suivants :
- des lobes de protoxylème en forme de col (« protoxylème mésarche », le personnage qui leur a donné leur nom et qui les a fait proposer pour la première fois en tant que groupe monophylétique, Kenrick et Crane 1997).
- un pseudoendospore
- un tapetum plasmodial
- des racines adventives provenant latéralement de l'endoderme
- des spermatozoïdes multicilieux, avec 30 à 1000 cils ou flagelles.
Pour plus de caractères morphologiques, voir Renzaglia et al. 2000 et Schneider et al. 2002a.
Pour une description plus basique de la morphologie du taxon, voir Pteridophyta.
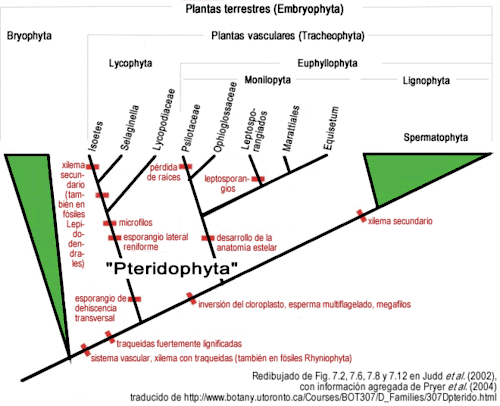
Phylogénie
Avec les Lycopodiophyta, les monilophytes forment le groupe paraphylétique des Pteridophyta, une ancienne division qui regroupe les soi-disant « fougères et affinés ». Aujourd'hui, après une analyse génétique robuste, il a été décidé de diviser les plantes vasculaires en Lycophyta et Euphyllophyta (« plantes à vraies feuilles »), et au sein des Euphyllophyta se trouvent les divisions des Monilophyta et des Lignophyta (le seul clade de Lignophyta actuellement toujours vivant est celui des Spermatophytina).
Selon les analyses génétiques les plus récentes parmi les monilophytes vivants[2] et leur relation probable avec les monilophytes disparus[3], la phylogénie est la suivante :
| Monilophyta |
| ||||||||||||||||||||||||
Des études antérieures ont donné les résultats suivants :
Systématique
Le clade des Monilophyta a été créé en 2007 par Philip Douglas Cantino (d) et Michael John Donoghue (d) dans une publication coécrite avec de nombreux autres botanistes[4].
L'une des dernières classifications est celle de Christenhusz et al. 2011 (es)[5],[6],[7] (basée sur Smith et al. 2006 (es)[8], 2008)[9] qui fournit également une séquence linéaire des lycophytes et des monilophytes.
Le système de classification de 2006 a été proposé par Smith et al. à la lumière des progrès récents de la phylogénie des monilophytes. C'est une classification phylogénétique et non morphologique, donc dans certains nœuds, il est encore difficile de dire quels sont les caractères morphologiques qui caractérisent chaque clade. Beaucoup de ses nœuds sont déjà reconnus comme phylogénétiques, principalement en ce qui concerne les eusporangiés et les nœuds basaux des leptosporangiés. Ils reconnaissent que la recherche fait encore défaut, en particulier au niveau du genre. Bien que les genres continuent de muter à cause de cela, la classification jusqu'au niveau de la famille peut déjà être considérée comme phylogénétique.
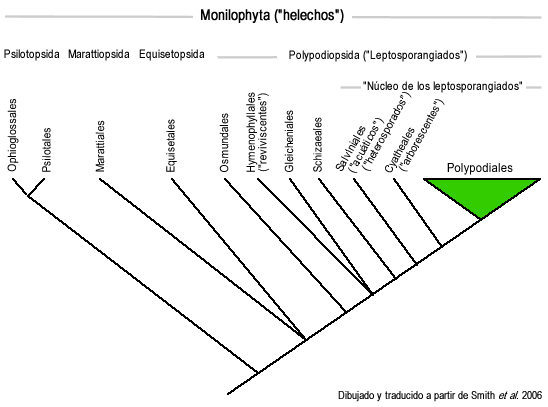
Le classification des ordres est la suivante :
- Monilophyta (« fougères »)
- Equisetopsida ou Equisetidae
- Equisetales (famille 4)
- Psilotopsida ou Ophioglossidae
- Ophioglossales (famille 5)
- Psilotals (famille 6)
- Marattiopsida ou Marattiidae
- Marattiales (famille 7)
- Polypodiopsida ou Polypodiidae (« fougères leptosporangiées ») familles 8 à 48
- Osmundales (famille 8)
- Hyménophyllales (famille 9)
- Gleicheniales (familles de 10 à 12 ans)
- Schizaeales (familles 13 à 15)
- « Noyau du leptosporangiate » : Salviniales + Cyatheales + Polypodiales
- Salviniales (« fougères aquatiques », « fougères hétérosporiques ») (familles 16 et 17)
- Cyatheales (familles 18 à 25)
- Polypodiales (« polypodes ») (familles 26 à 48)
- " Eupolypodiales " (I et II):
- "Eupolypodiales II" (Aspleniaceae + Woodsiaceae + Thelypteridaceae + Blechnaceae + Onocleaceae)
- "Eupolypodiales I" (Dryopteridaceae + Lomariopsidaceae + Tectariaceae + Oleandraceae + Davalliaceae + Polypodiaceae)
- Equisetopsida ou Equisetidae
Certains auteurs ne sont pas d'accord pour faire une classification phylogénétique au détriment d'une classification morphologique ; les auteurs de cette classification soutiennent qu'une classification phylogénétique éclaire et permet une révision des caractères morphologiques et dans un sens plus large de la biologie des taxons, et qu'elle est la meilleure lorsque l'on travaille avec des questions sur l'évolution et la phytogéographie des taxons impliqués.
Écologie et évolution
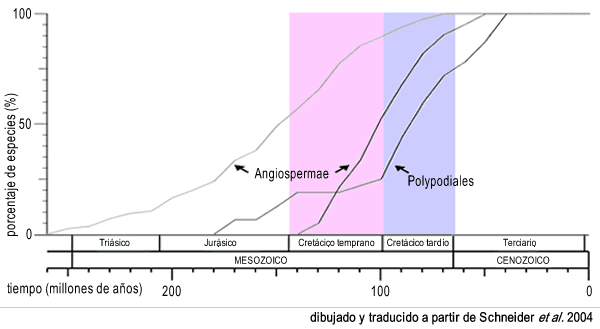
Le clade monilophyte comprend plus de 10 000 espèces de plantes, c'est donc le deuxième plus grand groupe de plantes vasculaires, surpassé en nombre seulement par les Angiospermes (estimés à 250 000 à 300 000 espèces vivantes). Selon les archives fossiles, les monilophytes ont subi une augmentation marquée de leur diversité et de leur abondance pendat le Carbonifère et le Jurassique, mais les archives fossiles chutent fortement au Crétacé (il y a 140 ~ 75 millions d'années). Les fossiles montrent également que les angiospermes se sont diversifiés à cette époque, en venant dominer la flore à la fin du Crétacé. Bon nombre des genres actuels de fougères ne sont apparus qu'au début du Tertiaire. En particulier, l'énorme diversité que présentent les Polypodiales, un clade qui en représente plus de 80 % des espèces de fougères actuelles, que les classifications traditionnelles avaient tendance à diviser en un grand nombre d'ordres tels que les Pteridales, Aspidiales, Aspleniales, etc. Dans les archives fossiles, la grande majorité des fougères trouvées au Tertiaire correspondent à ce clade. Les plus anciens fossiles trouvés de Polypodiales sont des sporanges et des racines datant du début du Crétacé. À quelle époque les fougères actuelles se sont-elles diversifiées ? Les archives fossiles des fougères du Crétacé sont très pauvres, il n'est donc pas possible d'y répondre. Elles peuvent s'être diversifiées à tout moment du Crétacé précoce au Tertiaire. Schneider et coll. (2004) attribuent ce manque d'information principalement à trois causes :
- La plupart des études paléobotaniques se sont concentrées sur les angiospermes, laissant de côté les fougères.
- De nombreuses Polypodiales sont des épiphytes ou occupent des niches écologiques qui ont peu de chances d'être bien préservées sous forme de fossiles.
- Les spores des Polypodiales du Crétacé, contrairement à celles des actuelles, ont subi un « détachement de la perine », elles étaient donc plates et sans ornements, ce qui élimine la possibilité de déterminer à quelle fougère elles appartenaient.
Cette pauvreté dans les archives fossiles n'a pas empêché les chercheurs d'émettre leurs hypothèses ; en fait, la preuve fossile du déclin de la diversité des fougères, ajoutée à la diversification subie par les Angiospermes au Crétacé, a conduit à la croyance répandue que les fougères, qui avaient été auparavant une composante majeure des écosystèmes terrestres, a succombé à la prédominance écologique des angiospermes, et ceux qui survivent aujourd'hui doivent être pour la plupart des vestiges de ceux qui ont évolué au Paléozoïque et au début du Mésozoïque. Même ainsi, de nombreux genres actuels de fougères ne sont apparus qu'au début du Tertiaire, ce qui nous offre un scénario évolutif complètement différent, dans lequel la diversification des fougères telles que nous les connaissons aujourd'hui semble s'être produite après la diversification des angiospermes.
Aujourd'hui, de nouveaux arbres phylogénétiques de fougères et d'angiospermes, très consensuels, nous aident à comprendre les événements évolutifs qui se sont produits à cette époque et à expliquer les découvertes faites à partir des fossiles. Avec ces arbres phylogénétiques, nous pouvons faire des approximations moléculaires pour estimer l'âge de divergence de chaque clade, mais, en raison des limites de leur pouvoir prédictif, certains auteurs ont commencé à opter pour l'ajout à leurs estimations moléculaires de l'âge des informations obtenues à partir de l'enregistrement fossile, avec lesquelles ils créent des estimations de la date de divergence de chaque clade. Cette intégration des approches moléculaires avec les âges obtenus à partir de l'enregistrement des fossiles s'est avérée être un outil de plus en plus efficace pour identifier les tendances et les événements de la spéciation et de l'évolution (Soltis et al. 2002).
En utilisant des estimations du moment de la spéciation des fougères et des angiospermes, basées sur des données moléculaires limitées par des estimations d'âge obtenues à partir des données fossiles, Schneider et al. (2004) émettent l'hypothèse que le clade fougère polypodique s'est diversifié au Crétacé, après la diversification des angiospermes. Selon ces auteurs, cela suggère que ce clade s'est diversifié de manière opportuniste, en profitant des nouvelles niches écologiques offertes par le nouvel environnement dominé par les angiospermes (Schneider et al. 2004).
 |
Publication originale
- (en) Philip D. Cantino, James A. Doyle, Sean W. Graham, Walter S. Judd, Richard G. Olmstead, Douglas E. Soltis, Pamela S. Soltis et Michael J. Donoghue, « Towards a phylogenetic nomenclature of Tracheophyta », Taxon, Utrecht, Association internationale pour la taxonomie végétale (d) et Wiley, vol. 56, no 3, et , p. 822–846 (ISSN 0040-0262 et 1996-8175, DOI 10.1002/TAX.563001, JSTOR 25065865, lire en ligne)
Notes et références
- MNHN & OFB [Ed]. 2003-présent. Inventaire national du patrimoine naturel (INPN), Site web : https://inpn.mnhn.fr, consulté le 26 janvier 2021
- Theodor Cole & Hartmut Hilger 2013 Trachaeophyte Phylogeny « Trachaeophyte Phylogeny » (sur l'Internet Archive),
- Amram Eshel & Tom Beeckman 2013, Plant Roots: The Hidden Half, 4th Ed. CRC Press
- Cantino et al. 2007, p. 830
- Christenhusz et al. 2011. A linear sequence of extant families and genera of lycophytes and ferns. Phytotaxa 19: 7-54. (pdf)
- Preface to “Linear sequence, classification, synonymy, and bibliography of vascular plants: Lycophytes, ferns, gymnosperms and angiosperms” pdf
- Corrections to Phytotaxa 19: Linear sequence of lycophytes and ferns pdf
- A. R. Smith, K. M. Pryer, E. Schuettpelz, P. Korall, H. Schneider, P. G. Wolf. 2006. "A classification for extant ferns". Taxon 55(3), 705-731 ( pdf)
- Smith, A.R., Pryer, K.M., Schuettpelz, E., Korall, P., Schneider, H., & Wolf, P.G. (2008) Fern classification, pp. 417–467 en: Ranker, T.A., & Haufler, C.H. (eds.), Biology and Evolution of Ferns and Lycophytes. Cambridge, Cambridge University Press.
Voir aussi
Liens externes
- Stevens, PF (à partir de 2001). Site Web sur la phylogénie des angiospermes. Mis à jour régulièrement.
- Laboratoire de Pryer avec les fichiers PDF des publications dans lesquelles l'auteur est impliqué.
- (fr) Référence INPN : Monilophyta (consulté le )
- (en) Référence BioLib : Monilophyta Cantino & Donoghue (consulté le )
Bibliographie
- (en) Kathleen M. Pryer, Harald Schneider, Alan R. Smith et Raymond Cranfill, « Horsetails and ferns are a monophyletic group and the closest living relatives to seed plants », Nature, vol. 409, no 6820, , p. 618–622 (ISSN 1476-4687, DOI 10.1038/35054555, lire en ligne, consulté le )
- (en) Judd, Walter S., Plant systematics : a phylogenetic approach, Sinauer Associates, (ISBN 0-87893-403-0, 978-0-87893-403-4 et 0-87893-402-2, OCLC 50090078, lire en ligne)
- (en) Alan R. Smith, Kathleen M. Pryer, Eric Schuettpelz et Petra Korall, « A classification for extant ferns », TAXON, vol. 55, no 3, , p. 705–731 (ISSN 0040-0262, DOI 10.2307/25065646, lire en ligne [PDF], consulté le )
- (en) Karen Sue Renzaglia, R. Joel Duff, Daniel L. Nickrent et David J. Garbary, « Vegetative and reproductive innovations of early land plants: implications for a unified phylogeny », Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences, vol. 355, no 1398, , p. 769–793 (ISSN 0962-8436 et 1471-2970, DOI 10.1098/rstb.2000.0615, lire en ligne [PDF], consulté le )
- (en) Kathleen Pryer, Paul Wolf, Harold Schneider et Alan Smith, « Evolution of vascular plant body plans », dans Systematics Association Special Volumes, CRC Press, (ISBN 978-0-415-25790-9, lire en ligne), p. 330–364
- (en) Harald Schneider, Eric Schuettpelz, Kathleen M. Pryer et Raymond Cranfill, « Ferns diversified in the shadow of angiosperms », Nature, vol. 428, no 6982, , p. 553–557 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/nature02361, lire en ligne [PDF], consulté le )
- (en) P. S. Soltis, D. E. Soltis, V. Savolainen et P. R. Crane, « Rate heterogeneity among lineages of tracheophytes: Integration of molecular and fossil data and evidence for molecular living fossils », Proceedings of the National Academy of Sciences, vol. 99, no 7, , p. 4430–4435 (ISSN 0027-8424 et 1091-6490, DOI 10.1073/pnas.032087199, lire en ligne [PDF], consulté le )
- Portail de la botanique