Ponticola kessleri
Neogobius kessleri • Gobie de Kessler, Gobie à grosse tête

- Gobius platycephalus Kessler, 1857
- Gobius kessleri Günther, 1861
- Neogobius kessleri (Günther, 1861)

LC : Préoccupation mineure
[1]
Le Gobie de Kessler (Ponticola kessleri, synonyme Neogobius kessleri), appelé aussi Gobie à grosse tête, est une espèce de poissons de la famille des Gobiidae. Ce gobie est un poisson benthique d'eau douce à saumâtre, originaire d'Eurasie, considéré comme étant une espèce relique pontocaspienne.
Depuis la fin des années 1990, il tend à élargir son aire de présence vers l'ouest ; extension facilitée par la construction d'un réseau de plus en plus interconnecté de canaux, et peut être par le réchauffement climatique[2].
Quand on lui applique la méthode « FISK » (Fish Invasiveness Screening Kit), il présente les caractéristiques d'espèce exotique envahissante, avec un risque élevé d'invasion biologique en France (tout comme le Gobie à taches noires (Neogobius melanostomus), alors que le Gobie demi-lune (Proterorhinus semilunaris), originaire de la même région, semble présenter un risque modéré de ce point de vue).
Dénominations
- Le nom scientifique valide complet de l'espèce généralement accepté est Ponticola kessleri (Günther, 1861)[3]. Le nom du genre Ponticola est dérivé du grec Πόντος, le Pont suivi du suffixe latin -cola, qui habite, et il évoque ses régions d'origine (bassin ponto-caspien). L'épithète spécifique rend hommage au naturaliste russe Karl Fedorovich Kessler (1815-1881)[4], qui a été le premier à décrire ce poisson en 1857 sous le nom de Gobius platycephalus, nom qui sera changé en 1861 par le zoologiste britannique d'origine allemande Albert Günther (1830-1914). Certaines bases mentionnent toutefois Neogobius kessleri (Günther, 1861) comme étant le taxon valide[3],[5].
- Noms vulgaires (vulgarisation scientifique) recommandés ou typiques en français : Gobie de Kessler[6] ou Gobie à grosse tête[7],
- Autres noms vulgaires ou noms vernaculaires (langage courant) pouvant désigner éventuellement d'autres espèces : gobie. En dehors des francophones, cette espèce est également appelée bighead goby en anglais (soit « gobie à grosse tête ») ou bien Kesslergrundel en allemand et Kesslers grondel en néerlandais (soit « Gobie de Kessler »).
Description
 Taille adulte
Taille adulte Spécimen dans une main humaine
Spécimen dans une main humaine Tête en gros plan
Tête en gros plan
Aspect externe
Cette espèce est caractérisée par sa grosse tête aplatie aux joues proéminentes, ce qui lui vaut son nom vernaculaire de « gobie à grosse tête ». La tête se prolonge par un corps de forme plus conique qu'aplatie, légèrement épaissie sur la partie antérieure. Le Gobie de Kessler mesure jusqu'à 20 cm dans son aire d'introduction récente[8] mais jusqu'à 22 cm dans son milieu d'origine[9].
Couleur et robe : Sa couleur varie du rougeâtre au gris-brun foncé avec 5 lignes transversales plus ou moins marquées sur le dos, dont l'une est au niveau de la base de la nageoire caudale.
La tête présente un aspect marbré/tacheté avec des points plus clairs sur les côtés. Le ventre est pâle, couleur blanc-crème à jaunâtre ou grisâtre. La base de la nageoire pectorale présente des taches brunes formant une structure évoquant une vague[10]. Les nageoires impaires ont des lignes de taches foncées. Ce poisson se confond assez facilement avec un substrat de sable ou gravier grossier. Une tache sombre triangulaire est visible près de la nageoire caudale.
Chez l'adulte, la bouche est large, à lèvres épaisses, avec une lèvre inférieure plus grosse et plus avancée que la lèvre supérieure (la mandibule est plus longue que le maxillaire). Sa bouche peut s'ouvrir plus largement que celle des autres espèces de gobies eurasiatiques d'eau douce ou saumâtre.
La ventouse abdominale (ou « disque pelvien ») qui lui sert aussi pour prendre appui sur le fond a une forme de cuillère assez creuse. Anatomiquement parlant, elle est issue d'une soudure des deux nageoires pelviennes. La forme et taille de cette « ventouse » comptent parmi les critères d'identification de l'espèce : elle est cernée d'arêtes et ne parvient pas à l'anus. Le fraenum pelvien est en forme de disque avec des lobes angulaires sur les côtés près de l'attache du disque sur le corps et la longueur du fraenum est de 1/6 à 1/2 de sa largeur à la base.
Risques de confusion ; critères distinctifs

Ce gobie du bassin de la mer Noire se distingue (parfois assez difficilement) de ses congénères de la même famille par quelques caractères :
- Il est presque toujours en mouvement et considéré comme étant plus agressif que les autres gobies introduits en eau douce en France[8]
- Les premiers et avant-derniers rayons mous de la deuxième dorsale sont de longueur égale chez cette espèce. Il se différencie aussi du Gobie à taches noires (Neogobius melanostomus) par l’absence d'une tache noire ovale sur la première dorsale[8] ;
- Il n'a pas de narines en forme de tube, ce qui le différencie du Gobie demi-lune (Proterorhinus semilunaris), et ce dernier préfère en outre les habitats riches en végétaux[8] ;
- une longueur de museau équivalent à 1,5 à 2 fois le diamètre de l’œil ;
- la tête de ce gobie apparait plus « joufflue » et plus grosse que celles des 4 autres espèces pontocaspiennes qui tendent à coloniser l'Europe de l'Ouest via les canaux. Parmi les 5 espèces de gobiidés d'Europe centrale qui tendent à coloniser l'Europe de l'Ouest, c'est celle qui la tête la plus longue[9] ;
- 75 à 95 % de sa longueur totale est comprise entre sa tête et l'anus ;
- les écailles cténoïdes couvrent totalement la zone prédorsale et la nuque ;
- écailles de la série médio-latérale : 68 à 72 + 4/3 ;
Physiologie
Parce que dépourvus de vessie natatoire les gobies sont considérés comme de piètres nageurs, passant beaucoup de temps posés sur le substrat ou à proximité.
Cette espèce a longtemps été considérée comme ayant une faible capacité de dispersion, mais certains individus colonisateurs paraissent pouvoir effectuer des migrations importantes, peut être avec l'aide involontaire (ou parfois volontaire) de l'Homme (voir plus bas, le chapitre sur les capacités de dispersion de l'espèce).
Régime alimentaire
Ce gobie semble être le plus piscivore des gobies introduits en Europe de l'Ouest à partir de l'Est du sous-continent eurasiatique.
Son régime alimentaire semble significativement varier en fonction des ressources les plus accessibles pour lui dans l'habitat qu'il occupe, mais une étude faite dans l'estuaire du Dniestr a montré qu'il se nourrit là-bas principalement de poissons (jusqu'à 92 % de son régime alimentaire, en poids).
Dans ce même environnement, un crustacé amphipode (Corophium chelicorne) et une minuscule crevette d'eau douce (Paramysis intermedia) complètent son régime alimentaire (jusqu'à 7 %), avec aussi quelques mollusques (1 %) et vers polychètes (1 %)[11].
Reproduction
Le frai se produit entre février et septembre, à des dates et conditions variant selon l'habitat et le lieu géographique.
Comme chez tous les gobies eurasiatiques d'eau douce, les mâles construisent un nid où ils vont surveiller les œufs (en les oxygénant) jusqu'à leur éclosion[réf. nécessaire].
Habitat
Cette espèce vit sur les fonds de cours d'eau où elle peut momentanément résister à des courants importants, mais peut aussi circuler ou survivre dans les canaux où elle « colonise les blocs de pierre de consolidation des berges »[9] ;
Répartition
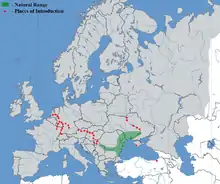
En rouge : corridors de colonisation (canaux) vers l'ouest et le nord-ouest (depuis les années 1990).

Originellement, et jusqu'à il y a peu, Le Gobie de Kessler vivait dans le Bassin de la mer Noire et principalement dans le Danube, le Dniestr, le sud de la rivière Bug et dans le bassin versant du Dniepr[12] (On l'y trouve jusqu'à Kiev). Il est présent dans des lagunes et des estuaires de la mer Noire (surtout au nord-ouest, près de la côte bulgare, et dans certains lacs (notamment dans les lacs Mandra, Vaya, Varna, Beloslavsko)[13]. Il est absent du bassin de la mer d'Azov ;
Nouveaux territoires
Depuis la fin des années 1990, sa population s'étend régulièrement vers l'amont du bassin versant du Danube, et vers l'Europe de l'Ouest.
En 1996, le Gobie de Kessler est repéré comme "Espèce introduite et non-indigène dans la section slovaque du Danube[14],[15].
En 1999, il a été enregistré pour la première fois en Allemagne (à 2 400 km de la mer). En 2005, on le trouve dans la partie supérieure du bassin du Rhin, près du canal le reliant au Danube. Il a rapidement colonisé les cours inférieur et moyen du Rhin. Selon une analyse réalisée dans le Rhin inférieur, sa première observation a été faite dans le Main à hauteur de Freudenberg (données non publiées de la BfG) ; avant qu’il soit repéré en 2006 dans le Rhin à hauteur de Königswinter[16]. Et il est lentement en train d'envahir le Rhin supérieur.
Durant la période 2000-2002, il a été découvert dans les petits ruisseaux de la côte de la mer Noire dans l'Est de la Turquie[17]
En 2004, cette espèce présentait la densité la plus élevée et la répartition la plus étendue (pour les 4 espèces de Gobiidae[18]). Dans le bassin du Danube, il est mentionné comme non-autochtone dans la rivière Tisza[19]. Dans le Haut-Danube il a été observé dans les régions autrichiennes et allemandes jusqu'à la ville de Straubing[20],[21].
En 2009, il est aussi présent dans le bassin de la mer du Nord, dans la rivière Waal aux Pays-Bas[22]. Dans la partie allemande du bas Rhin (entre Cologne et Rees), il est largement dominant parmi la population des gobies introduits : 52 % des gobies capturés en 2009 dans cette partie du bassins versants étaient de l'espèce Ponticola kessleri[23].
En 2011, la nouvelle aire de l'espèce s'était étendue à tout le Rhin en Allemagne, en France, et en Suisse, et on le trouve aussi dans une partie française de la Moselle[24].
Niche écologique
Dans les cours d’eau nouveaux pour l'espèce, ce poisson pourrait occuper une niche écologique légèrement différente de celles des autres espèces de gobies récemment introduits dans le Rhin et ses affluents[16] sauf peut-être du gobie à tache noire dont il serait le plus proche en termes d'habitats recherchés[8].
En particulier, Števove & Kováč ont, en 2013, montré que le gobie de Kessler et le gobie à taches noires dans le Danube (à Bratislava)[25] - alors qu'ils ont tous deux conjointement colonisé les mêmes nouveaux territoires en 20 ans - ont néanmoins des régimes alimentaires qui ne se chevauchent pas vraiment : 46 types d’aliments ont été répertoriés pour le gobie de Kessler (avec principalement Dikerogammarus sp., larves de chironomes et Corophium sp.) et 51 types d'aliments pour le gobie à tâches noires (qui semble rechercher les larves de chironomes, Corophium sp., mais aussi des bryozoaires et Cladocera)[25]. Leur régime alimentaire varie en outre saisonnièrement et selon les disponibilités de leur environnement. On a aussi montré dans la partie slovaque du Danube que le gobie de Kessler (comme le gobie à tâches noires) est très adaptable, capable de passer de proies de grande taille à des proies petites, à corps mou et/ou dur. Quand les deux espèces consomment des ressources similaires, leurs proportions diffèrent[25].
Quand elles le peuvent, ces deux espèces se montrent plutôt spécialistes, mais le gobie à tâches noires semble plus adaptable que celui-ci (passant plus facilement à une stratégie plus généraliste[25]).
Capacités et caractéristiques de dispersion
Il a été noté pour ces deux espèces que la colonisation d'un cours d'eau se fait plus vite vers l'aval et plus lentement vers l'amont. Ceci est expliqué notamment par la « dérive des larves »[26]. Selon Tierney & al. (2011), quand ce gobie ne dispose pas d'abris et de zones de repos, comme les autres espèces de gobies de la zones pontocaspienne, il peine également à remonter vers l'amont s'il doit lutter contre un courants de plus de 1,25 m/s[27]. Malgré tout, certaines passes à poissons (à bassins successifs, à entrées submergées ou les installations rustiques), peuvent être traversées par le gobie à taches noires, et donc a fortiori par le gobie de Kessler qui est un peu plus grand et plus vigoureux[24].
Quand l'espèce se déplace très vite, comme ce fut le cas en Europe de l'Ouest au début des années 2000 (et en amont des Grands lacs aux États-Unis pour des espèces proches), c'est presque toujours en suivant les grands « corridors fluviaux » ou les canaux utilisés par les péniches et navires. Ceci invite à penser que les eaux de ballast sont une source importante de dispersion de propagules pour ces espèces[28].
Espèce exotique envahissante
L'introduction volontaire ou accidentelle par l'Homme de nouvelles espèces « a souvent favorisé leur propagation et la colonisation des cours d'eau »[8].
À début du XXIe siècle, cette espèce est « très fréquente dans certaines parties du Main et du Rhin. C'est même l'une des espèces les plus fréquentes (plus de 50 % des individus) rencontrées sur les rives du Rhin inférieur »[9]
En France, la législation évolue peu à peu pour limiter ou prévenir les introductions incontrôlées d'espèces de poissons hors de leur aire naturelle de répartition. L’alinéa 2° de l'article L432-10 du Code de l'environnement précise « Est puni d’une amende de 9000 euros le fait d'introduire dans les eaux mentionnées par le présent titre des poissons qui n'y sont pas représentés ; la liste des espèces représentées est fixé par le ministre chargé de la pêche en eau douce (liste de l'arrêté du 17/12/1985) »[8].
La Commission internationale pour la protection du Rhin (CIPR) s’inquiète de voir le nombre d'espèces invasives ou potentiellement invasives régulièrement augmenter, dont pour les espèces de gobies originaires de la mer Noire et de la mer Caspienne ou de leurs bassins versant, qu'elle considère comme probablement introduites via des ballasts par le canal Rhin Main Danube pour au moins quatre espèces (le gobie demi-lune, le gobie de Kessler, le gobie à taches noires et le gobie fluviatile, dont certains sont maintenant trouvés jusque dans la Moselle et d'autres eaux du Nord-Est de la France[9]).
Le gobie de Kessler est encore mal connu de ce point de vue, mais le gobie à tache noire, mieux connu, est un invasif avéré alors que le gobie demi-lune semble avoir moins de capacités invasives[29].
Facteurs favorisants
La Commission Internationale pour la Protection du Rhin estime que leur diffusion pourrait être favorisée par :
- des migrations automnales utilisant des canaux qui relient des bassins versants autrefois isolés entre eux. Leurs écluses sont ouvertes de plus en plus souvent en raison de leur modernisation et d'un trafic croissant, permettant ainsi aux gobies de parcourir de grandes distances, de bief en bief.
- le transport dans les eaux de ballast des péniches ou autre type de bateau[30]. Les grands bateaux sont maintenant pour la plupart équipés d'une double coque dont l'espace sert également de volume pour le ballastage, rempli grâce à de puissantes pompes et prises d'eau situées dans la partie inférieure de la coque. Des espèces benthiques, et en particulier des gobies, peuvent être ainsi facilement capturées et ensuite relâchées à des centaines de kilomètres. Ceci expliquerait que des populations de gobies soient apparues très loin des populations existantes, sans qu'on ne détecte d'individu dans les canaux entre ces deux points (entre Lauterbourg et Kembs en 2010, ou entre Berg-sur-Moselle et le Luxembourg en 2011, alors que les suivis par pêche électrique n'avaient rien mis en évidence à Hettermillen la même année).
- le transport d’œufs de gobies adhérant à la coque de bateaux (dans le fouling)[31] ;
- le déversement involontaire dans le cadre d'alevinages d'autres espèces piscicoles[32] ;
- la mise en liberté dans la nature de poissons élevés ou pêchés et transporté pour servir d'appât pour la pêche au vif[33] ;
- le transfert d'eau du Danube dans le Main[34].
Effets des invasions biologiques
.jpg.webp)
Dans les zones où l'espèce a été introduite et pullule, les poissons adultes autochtones « n'entrent que pour une faible part dans son alimentation »[16], mais l'espèce fait preuve de résistance et de résilience. Ce poisson se montre « vorace » et « capable de modifier son régime alimentaire en fonction des ressources disponibles dans le milieu (...) il tend à se nourrir d’œufs de poissons (...) au-delà d'une certaine taille, exerce une prédation sur des poissons de petite taille »[8].
Depuis les années 1990, cinq espèces de gobies tendent à coloniser les bassins versants européens situés à l’ouest de leur aire naturelle de répartition, leurs impacts directs ou indirects, immédiats ou non, sont incomplètement cernés, mais ce sont probablement les suivants :
- effet de « concurrence alimentaire » avec les espèces autochtones (en régression) qui occupent ou occupaient la même niche écologique ;
- influence sur les organismes qu'ils mangent (invertébrés indigènes, petits poissons, œufs et larves de poissons notamment) ;
- impact attendu sur le réseau trophique et donc sur les peuplements d'espèces prédatrices (poissons piscivores, couleuvre, cormorans, hérons) ;
- Concurrence territoriale ou comportementale au niveau des habitats (failles et autres caches, frayères, etc.) ;
- possible introduction de parasites (phénomène assez fréquent quand une espèce introduite se montre invasive, mais non démontré à ce jour pour P. Kessleri).
Tout ou partie de ces effets pourraient expliquer par exemple le recul des chabots (Cottus sp.).
Position de la commission internationale pour la protection du Rhin (CIPR)
La CIPR estime qu’il est déjà trop tard pour les éradiquer ou même stopper leur progression dans le Rhin et ses affluents d'où, via les canaux, ils pourront gagner d'autres bassins (par exemple via le futur canal Seine-Nord) : « les gobies ne pourront être tenus à distance que dans les eaux (calmes) isolées dans lesquelles des restrictions d'alevinage auront éventuellement été émises ». Elle estime en outre nécessaire de « stabiliser, dans la plus grande mesure possible, les populations des espèces particulièrement touchées (qui restent à identifier) en prenant des mesures de restauration écologique, en améliorant la continuité, en instaurant des mesures spécifiques de soutien des espèces touchées, afin de maintenir durablement leurs peuplements et faire en sorte qu'elles puissent coexister avec les nouvelles espèces de gobies et d'autres néozoaires éventuels ». Elle engage les acteurs à affiner les inventaires naturalistes en cours pour les poissons et le macrozoobenthos, les espèces autochtones particulièrement affectées, et à « lancer si besoin est des analyses ciblées pour identifier les impacts des gobies sur la faune indigène de l'hydrosystème du Rhin. On pourra alors prendre des mesures de soutien devant permettre de garantir durablement le maintien des peuplements de ces espèces menacées et d’assurer leur coexistence avec les espèces néozoaires de gobies ».
Prédateurs et parasites
Parasites
La charge et le type de parasite semblent fortement varier selon la salinité du milieu où vit ce poisson. Son expansion vers l'ouest pourrait entrainer celle de certains de ses parasites, ce qui semble déjà être le cas pour Nicolla skrjabini, un ver plat (également transporté par l'escargot d'eau douce Lithoglyphus naticoides[35],[36])
Dans les eaux saumâtres de l'estuaire du Dniestr, des études ont montré que le gobie de Kessler héberge des parasites tels que les trématodes Nicolla skrjabini et des larves d'un nématode Eustrongylides excisus[37].
Dans le Moyen-Danube (en eau douce) ce gobie a été trouvée porteur de parasites bien plus nombreux (jusqu'à 33 espèces différentes, principalement des vers à tête épineuse Pomphorhynchus laevis, des glochidies de mollusques Anadonta anatina, et des nématodes tels que Raphidascaris acus[38]. Cette espèce peut aussi abriter des larves d'un endoparasite envahissant : Anguillicola crassus.
Dans la partie autrichienne du Danube, seules 5 espèces de parasites ont été enregistrées[39] : Infusoria trichodina sp., crustacés parasites Ergasilus sieboldi, trématodes Diplostomum sp. et toujours Nicolla skrjabini, ainsi que les acanthocéphales Acanthocephalus lucii.
Prédateurs

Hors de son milieu naturel, ils sont encore mal connus, mais parmi les oiseaux on peut au moins citer le héron cendré et le cormoran[40].
Dans le Danuble, ce gobie (et d'autres) peut aussi être mangé par des poissons piscivores (les gobies là où ils sont présents semblent ainsi jouer un rôle important dans l'alimentation du sandre), et des couleuvres[41].
Génétique
Cette espèce fait partie de celles dont le génome mitochondrial a été séquencé et publié (en 2014)[42].
Des méthodes de biologie moléculaire permettent de différentier les individus provenant du bassin de la mer Noire, d'individus provenant de celui de la mer Caspienne[43]. Elles ont permis de montrer (en 2013) chez des espèces proches (Neogobius fluviatilis et Neogobius melanostomus) une capacité d'hybridation entre espèces[44].
Dans le Danube après seulement dix à 15 générations les populations envahissantes semblent porter des gènes mitochondriaux provenant à la fois des bassins de la mer Noire et de la mer Caspienne[45].
Références
- Ponticola kessleri sur la Liste rouge UICN
- Harka A. and Biro P., 2007. New patterns in Danubian distribution of Ponto-Caspian gobies – A result of global climatic change and/or canalization ? Electronic Journal of Ichthyology , 1 , 1–14.
- Integrated Taxonomic Information System (ITIS), www.itis.gov, CC0 https://doi.org/10.5066/F7KH0KBK, consulté le 18 octobre 2015
- Karl Fedorovich Kessler
- (en) Référence World Register of Marine Species : taxon Neogobius kessleri (Günther, 1861) (+ liste espèces) (consulté le )
- Nom en français d'après l'Inventaire National du Patrimoine Naturel, sur le site Inventaire National du Patrimoine Naturel (INPN)
- Noms communs de Ponticola kessleri sur FishBase, consulté le 18 octobre 2015
- Fiche d'information sur les gobies, (fédération de pêche 57 réalisée avec L. MASSON, doctorante à l'Université de Trent (Canada), et l'aide de l’Agence de l’Eau Rhin-Meuse, 4 pp
- Commission internationale pour la protection du Rhin, Espèces allochtones de gobies dans l‘hydrosystème du Rhin (PDF)
- Froese, Rainer and Pauly, Daniel, eds. (2006). "Ponticola kessleri" dans FishBase. version avril 2006 .
- Strautman I.F. (1972) Pitaniye i pishchevyje vzaimootnoshenija bychkov (sem. Gobiidae) Dnestrovskogo limana. Vestnik Zoologii, 4: 35-38. (ru)
- Didenko, A. V. (2013). Gobiids of the Dniprodzerzhynsk Reservoir (Dnieper River, Ukraine): distribution and habitat preferences. Acta Ichthyologica et Piscatoria, 43(4), 257-266 (résumé).
- Smirnov A.I. (1986) Perch-likes (gobiids), scorpionfishes, flatfishes, clingfishes, anglerfishes [in:] Fauna of Ukraine, Vol. 8, No 5, Kiev: Naukova Dumka, 320 pp. (in Russian)
- Stráňai I. (1997) Neogobius kessleri v Dunaji. Poľovníctvo a rybárstvo, 49(8): 33.
- Zweimuller I., Moidl S. and Nimmervoll H., (1996), A new species for the Austrian Danube – Neogobius kessleri. Acta Univ. Carol. Biol. , 40 , 213–218
- Borcherding, J., Dolina, M., Heermann, L., Knutzen, P., Krüger, S., Matern, S., van Treeck, R. & Gertzen, S. (2012) Feeding and niche differentiation in three invasive gobies in the Lower Rhine, Germany, Limnologica
- Balik S., Turan D. (2004) A first record for the bighead goby (Neogobius kessleri Günther, 1861) along the Turkish eastern Black Sea coast. Turkish Journal of Zoology, 28: 107-109.
- Jurajda P., Černý J., Polačik M., Valová Z., Janáč M., Blažek R., Ondračková M. (2005) The recent distribution and abundance of non-native Neogobius fishes in the Slovak section of the River Danube. Journal of Applied Ichthyology, 21: 319–323
- Harka Á., Bíró P. (2007) New patterns in Danubian distribution of Ponto-Caspian gobies – a result of global climatic change and/or canalization ? Electronic Journal of Ichthyology, 1: 1-14.
- Wiesner C. (2003) Eingeschleppte Meeresgrundeln in der Österreichischen Donau – Gefahren und Potenziale. Am Fischwasser, 2: 29-31.
- Seifert K., Hartmann F. (2000) Die Kesslergrundel (Neogobius kessleri Günther, 1861), eine neue Fischart in der deutschen Donau. Lauterbornia, 38: 105-108.
- van Kessel N., Dorenbosch M., Spikmans F. (2009) First record of Pontian monkey goby, Neogobius fluviatilis (Pallas, 1814), in the Dutch Rhine . Aquatic Invasions, 4(2): 421-424.
- Borcherding J., Staas S., Krüger S., Ondračková M., Šlapanský L., Jurajda P. (2011) Non-native Gobiid species in the lower River Rhine (Germany): recent range extensions and densities . Journal of Applied Ichthyology, 27: 153–155.
- Manné S., Poulet N, Dembski S. (2013) Colonisation of the Rhine basin by non-native gobiids: an update of the situation in France. Knowledge and Management of Aquatic Ecosystems, 411: 02.
- Števove, B., & Kováč, V. (2013), Do invasive bighead goby Neogobius kessleri and round goby N. melanostomus (Teleostei, Gobiidae) compete for food?. Knowledge and Management of Aquatic Ecosystems, (410), 08 (résumé)
- Janác M, Šlapanský L, Valová Z & Jurajda P (2013). Downstream drift of round goby (Neogobius melanostomus) and tubenose goby (Proterorhinus semilunaris) in their non-native area. Ecol. Freshwat. Fish., 22 , 430–438 (voir p 260/367 de la version PDF)
- Tierney K.B, Kasurak A.V, Zielinski B.S & Higgs D.M (2011), Swimming performance and invasion potential of the round goby. Environ. Biol. Fish. , 92 , 491–502
- Kalchhauser, I., Mutzner, P., & Burkjardt-Holm, P. (2012) Tracing provenience and dispersal mode of gobies invading Switzerland by microsatellite analysis. Neobiota , 259.
- Le pêcheur professionnel, Les gobies à l'étude, consulté 2015-10-16
- par ex. Ahnelt et al. 1998, Wonham et al. 2000
- Sokolov et al. 1994
- Friedl & Sampl 2000
- Prášek & Jurajda 2005 Fiche Gobie, Les pêcheurs de Madine, consulté 2015-10-16
- Schöll 2008, Landwüst 2006
- Zhokhov A. E., Molodozhnikova N. M. & Pugacheva M. N. (2006). "Dispersal of invading trematodes Nicolla skrjabini (Iwanitzky, 1928) and Plagioporus skrjabini Kowal, 1951 (Trematoda: Opecoelidae) in the Volga". Russian Journal of Ecology 37(5): 363-365. doi:10.1134/S1067413606050110
- yutin A. V. & Slynko Yu. V. (2010). "The first finding of the Black Sea snail Lithoglyphus naticoides (Gastropoda) and its associated species-specific trematoda in the Upper Volga basin". Russian Journal of Biological Invasions 1(1): 45-49. doi:10.1134/S2075111710010091
- Kvach Y. (2004) « The metazoa parasites of gobiids in the Dniester Estuary (Black Sea) depending on water salinity »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?). Oceanological and Hydrobiological Studies, 33(3): 47–56.
- Ondračková M., Dávidová M., Blažek R., Gelnar M., Jurajda P. (2009) The interaction between an introduced fish host and local parasite fauna: Neogobius kessleri in the middle Danube River. Parasitology Research, 105: 201–208.
- Mühlegger J.M., Jirsa F., Konecny R., Frank C. (2010) Parasites of Apollonia melanostoma (Pallas 1814) and Neogobius kessleri (Guenther 1861) (Osteichthyes, Gobiidae) from the Danube River in Austria. Journal of Helminthology, 84: 87–92.
- Bzoma, S. & Stempniewicz, L. (2001): Great cormorants (Phalacrocorax carbo) diet in the Gulf of Gdansk in 1998 and 1999. Third International Symposium on Functioning of Coastal Ecosystems in Various Geographical Regions, June 19–22, 2001, Institute of Oceanography, University of Gdansk
- Weiperth, A., Potyó, I., & Puky, M. (2014). Diet Composition of the Dice Snake (Natrix Tessellata Laurenti, 1768) in the Danube River Catchment Area. Acta zoologica bulgarica, 7, 51-56.
- Kalchhauser, I., Kutschera, V. E., & Burkhardt-Holm, P. (2014). The complete mitochondrial genome of the invasive Ponto-Caspian goby Ponticola kessleri obtained from high-throughput sequencing using the Ion Torrent Personal Genome Machine. Mitochondrial DNA, (0), 1-3
- Kohout, J., Pekárik, L., Šedivá, A., Didenko, A., Čiampor, F., & Čiamporová‐Zaťovičová, Z. (2014). Discrimination between invasive Ponto‐Caspian gobies using a PCR‐RFLP method. Journal of Applied Ichthyology, 30(1), 121-126.
- Lindner, K., Cerwenka, A. F., Brandner, J., Gertzen, S., Borcherding, J., Geist, J., & Schliewen, U. K. (2013). First evidence for interspecific hybridization between invasive goby species Neogobius fluviatilis and Neogobius melanostomus (Teleostei: Gobiidae: Benthophilinae). Journal of fish biology, 82(6), 2128-2134.
- Cerwenka, A. F., Brandner, J., Geist, J., & Schliewen, U. K. (2014). Strong versus weak population genetic differentiation after a recent invasion of gobiid fishes (Neogobius melanostomus and Ponticola kessleri) in the upper Danube River. Aquat Invasions, 9, 71-86.
Voir aussi
Articles connexes
- Autres gobies envahissants :
- Neogobius melanostomus
- Neogobius fluviatilis
- Babka gymnotrachelus
- Proterorhinus semilunaris
- Liste des gobies
- Canal Rhin-Main-Danube
- Néozoaires
Liens externes
Bases taxinomiques
- (en) Référence Catalogue of Life : Ponticola kessleri (Günther, 1861) (consulté le )
- (fr+en) Référence FishBase : (consulté le )
- (fr+en) Référence ITIS : Ponticola kessleri (Günther, 1861) (Nom accepté: Neogobius kessleri (Günther, 1861)) Non valide (consulté le )
- (fr+en) Référence ITIS : Neogobius kessleri (Günther, 1861) (consulté le )
- (en) Référence NCBI : Ponticola kessleri (taxons inclus) (consulté le )
- (en) Référence UICN : espèce Ponticola kessleri (Günther, 1861) (consulté le )
- (en) Référence World Register of Marine Species : espèce Ponticola kessleri (Günther, 1861) (consulté le )
Autres liens externes
- Fiche Ponticola kessleri dans la base de données génomiques Mitofish, Atmosphere and Ocean Research Institute, the University of Tokyo, Japan.
- Fiche d'information sur les gobies (fédération de pêche 57, 4 pp)
Bibliographie
- Ponticola kessleri (Günther, 1861), Fiche INPN (Muséum)
- Eros T., Sevcsik A. and Toth B., (2005) Abundance and night-time habitat use patterns of Ponto-Caspian gobiid species (Pisces, Gobiidae) in the littoral zone of the River Danube, Hungary. J. Appl. Ichthyol., 21, 350–357
- Hohenadler, M. The effect of two different habitats on species traits of the two invasive Ponto-Caspian goby species Neogobius melanostomus and Ponticola kessleri in the Lower Rhine. Degree project in biology, Master of science (2 years), 201 ; Université d'uppsala
- Kalchhauser, I., Mutzner, P., Hirsch, P. E., & Burkjardt-Holm, P. (2013). Arrival of round goby Neogobius melanostomus (Pallas, 1814) and bighead goby Ponticola kessleri (Günther, 1861) in the High Rhine (Switzerland). BioInvasions Records, 2(1), 79-83
- Kalchhauser, I., Mutzner, P., & Burkjardt-Holm, P. (2012) Tracing provenience and dispersal mode of gobies invading Switzerland by microsatellite analysis. Neobiota , 259.
- Kovac, V., Copp, G. H., and Sousa, R. P. (2009). "Life-history traits of invasive bighead goby Neogobius kessleri (Gunther, 1861) from the middle Danube River, with a reflection on which goby species may win the competition." Journal of Applied Ichthyology, 25(1), p. 33-37.
- Kovac, V., Siryova, S. (2005). Ontogenetic variability in external morphology of bighead goby Neogobius kessleri from the Middle Danube, Slovakia“ ; J. Appl. Ichthyol. 21, p. 312-315
- Mutzner, P. (2012). Genetic Diversity and Population Structure of the Invasive Goby Species Ponticola Kessleri in Kleinhueningen and Birsfelden (Doctoral dissertation).
- Neilson, M. E., & Stepien, C. A. (2009). Escape from the Ponto-Caspian: evolution and biogeography of an endemic goby species flock (Benthophilinae: Gobiidae: Teleostei). Molecular Phylogenetics and Evolution, 52(1), 84-102.
- Ondračková, M., Valová, Z., Hudcová, I., Michálková, V., Šimková, A., Borcherding, J., & Jurajda, P. (2015). Temporal effects on host-parasite associations in four naturalized goby species living in sympatry. Hydrobiologia, 746(1), 233-243.
- Piria, M., Šprem, N., & Treer, T. (2015). Distribution, abundance and condition of invasive Ponto-Caspian gobies Ponticola kessleri (Günther, 1861), Neogobius fluviatilis (Pallas, 1814), and Neogobius melanostomus (Pallas, 1814) in the Sava River basin, Croatia. Journal of Applied Ichthyology, 31(5), 888-894 (résumé).
- Piria, M., Jakšić, G., Jakovlić, I., & Treer, T. (2015). Dietary habits of invasive Ponto-Caspian gobies in the Croatian part of the Danube River basin and their potential impact on benthic fish communities. Science of The Total Environment.
- Seifert K, Hartmann F (2000) Die Kesslergrundel (Neogobius kessleri Günther 1861), eine neue Fischart in der deutschen Donau. Lauterbornia 38: 105–108
- Stranaï I., 1998. Morphometry study on Neogobia kessleri (Günther 1861) from the main stream of the Danube river. Czech J. Anim. Sci., 43, 289–292
- Števove, B., & Kováč, V. (2013), Do invasive bighead goby Neogobius kessleri and round goby N. melanostomus (Teleostei, Gobiidae) compete for food?. Knowledge and Management of Aquatic Ecosystems, (410), 08 (résumé).
- Vyskocilova M, Ondrackova M, Simkova A, Martin JF (2007) Isolation and characterization of microsatellites in Neogobius kessleri(Perciformes, Gobiidae) and cross-species amplification within the family Gobiidae. Molecular Ecology Notes 7:701-704.
- Weiperth A (2014) Analysis of Structure, Composition, Spatial and Temporal Changes of Juvenile Fish Community in a Danube-Tributary System in the Middle Danube River Basi. Acta zoologica bulgarica, 45-50.
- Wiesner, C. (2005), New records of non‐indigenous gobies (Neogobius spp.) in the Austrian Danube. Journal of Applied Ichthyology, 21(4), 324-327 (résumé).
- Portail de l’ichtyologie