Potentiel de Rydberg-Klein-Rees
Le potentiel de Rydberg-Klein-Rees, en abrégé potentiel RKR, est un potentiel interatomique de molécules diatomiques basé sur une approche semi-classique, recalé sur un spectre rovibrationnel mesuré. Il est dû à Ragnar Rydberg[1],[2] et Oskar Klein[3] qui l'ont mise au point (1932) et Albert Lloyd George Rees[4] qui a proposé une méthode d'approximation numérique (1947).
La méthode a été généralisée au domaine quantique grâce à une approche perturbative par Kosman et Hinze (1975)[5].
Du potentiel au spectre
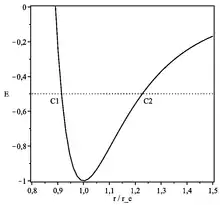
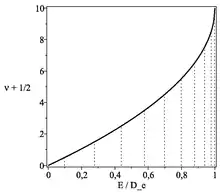
Dans l'approximation Brillouin-Kramers-Wentzel l'équation de Schrödinger s'écrit :
où :
- : masse réduite des deux atomes,
- : potentiel électronique,
- : nombre quantique du moment angulaire total,
- : fonction d'onde,
- : énergie.
La solution est recherchée sous la forme suivante :
En reportant dans l'équation de Shrödinger on obtient :
Compte tenu de la valeur de on peut négliger le premier terme de cette équation dont la solution est alors :
En dérivant cette expression et en reportant dans l'équation de Schrödinger on obtient une solution à l'ordre 1 de la fonction d'onde :
Cette approximation n'est pas bonne dans le voisinage des points tournants (points C1 et C2 de la figure 1) où . Toutefois une approximation linéaire locale du potentiel est possible : la solution correspondante est une fonction d'Airy.
La condition de quantification est que l'intégrale de Q entre C1 et C2 soit un multiple demi-entier de π[6].
où est le nombre quantique vibrationnel.
Il s'agit d'une équation sur les valeurs propres illustrée sur la figure 2 :
Du spectre au potentiel
Il existe diverses méthodes permettant de remonter au potentiel à partir de la donnée du spectre[7]. Elles sont basées sur deux types d'approche.
Potentiel modèle
La première méthode consiste à utiliser un potentiel analytique comme le potentiel de Dunham basé sur un développement autour de la position d'équilibre définie par . Ce potentiel s'écrit :
De même :
La condition de quantification devient :
Les coefficients s'expriment en fonction des constantes spectroscopiques[8]. En ne retenant que les premiers termes du développement on reconnait le potentiel de Morse. Cette méthode a l'avantage de donner une expression analytique du potentiel mais est d'une précision limitée au grandes valeurs de r.
Approche directe
On utilise aujourd'hui un calcul direct basé sur l'approche de Klein et Rees après avoir levé les singularités apparaissant dans les expressions[7]. Ce calcul permet d'obtenir les points tournants par de simples quadratures.
Références
- (de) R. Rydberg, « Graphische Darstellung einiger bandenspektroskopischer Ergebnisse », Zeitschrift für Physik, vol. 73, nos 5-6, , p. 376-384 (DOI 10.1007/BF01341146)
- (de) R. Rydberg, « Über einige Potentialkurven des Quecksilberhydrids », Zeitschrift für Physik, vol. 80, nos 7-8, , p. 514-524 (DOI 10.1007/BF02057312)
- (de) O. Klein, « Zur Berechnung von Potentialkurven für zweiatomige Moleküle mit Hilfe von Spektraltermen », Zeitschrift für Physik, vol. 76, nos 3-4, , p. 226-235 (DOI 10.1007/BF01341814)
- (en) A. L. G. Rees, « The calculation of potential-energy curves from band-spectroscopic data », Proceedings of the Physical Society, vol. 59, no 6, , p. 998-1008 (DOI 10.1088/0959-5309/59/6/310)
- (en) Warren M. Kosman et Juergen Hinze, « Inverse perturbation analysis: Improving the accuracy of potential energy curves », Journal of Molecular Spectroscopy, vol. 56, no 1, , p. 93-103 (DOI 10.1016/0022-2852(75)90206-4)
- (en) M. S. Child, Semiclassical Mechanics with Molecular Applications, Oxford, Oxford University Press, , 433 p. (ISBN 978-0-19-967298-1, lire en ligne)
- (en) Robert J. LeRoy, Equilibrium Structures of Molecules, Taylor & Francis, (lire en ligne), « Chap. 6: Determining Equilibrium Structures and Potential Energy Functions for Diatomic Molecules »
- « Diatomic Spectral Database, 1Σ-Ground State Molecules », sur National Institute of Standards and Technology
Liens externes
- (en) Robert J. Le Roy, « University of Waterloo, Department of Chemistry, Computer Programs: RKR1-16 »
Voir aussi
- Potentiel sphères dures
- Potentiel de Lennard-Jones
- Potentiel de Buckingham
- Potentiel de Stillinger-Weber
- Potentiel de Sutherland
- Potentiel de van der Waals
- Portail de la physique
- Portail de la chimie