Procédé Castner-Kellner
Le procédé Castner–Kellner est une méthode d'électrolyse d'une solution aqueuse de chlorure alcalin pour produire l'hydroxyde alcalin correspondant[1]. Cette méthode fut inventée par l’américain Hamilton Castner et l'autrichien[2] Karl Kellner dans les années 1890.
Détail du processus
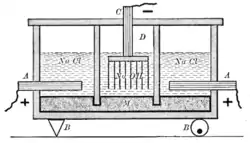
L'appareil original est divisé en deux types de cellules séparée par des parois en ardoise. Le premier type, à droite et à gauche du schéma, utilise un électrolyte de chlorure de sodium en solution, une anode en graphite (A), et une cathode en mercure (M). L'autre type de cellule, au centre du schéma, utilise un électrolyte d'hydroxyde de sodium en solution, une anode de mercure (M), et une cathode en fer (D). À noter que l'électrode de mercure est partagée entre les trois compartiments.
La réaction à l'anode (A) est :
- 2Cl− → Cl2 + 2e−
Le chlore gazeux qui en résulte s'accumule au sommet des cellules extérieur où il est recueilli comme sous-produit du processus. La réaction à la cathode de mercure extérieure est :
- 2Na+ + 2e− → 2Na
Le sodium métallique formé est dissous dans le mercure sous la forme d'un amalgame. Le mercure conduit le courant des cellules extérieures vers la cellule centrale. Par ailleurs, un mécanisme à bascule (B représenté par point d'appui à gauche et le rotateur excentrique à droite) agite le mercure pour transporter le sodium métallique dissous dès cellules externes vers la cellule interne.
La réaction à l'anode de la cellule centrale se déroule à l'interface entre le mercure et la solution d'hydroxyde de sodium.
- 2Na (amalgam) → 2Na+ + 2e−
Finalement, la réaction à la cathode de fer (D) est :
- 2H2O + 2e− → 2OH− + H2
Le résultat est que la concentration de chlorure de sodium dans les cellules externe diminue tandis que celle de la cellule centrale augmente. Au fur et à mesure du processus la solution d'hydroxyde de sodium est retirée de la cellule centrale en tant que produit final et est remplacée par de l'eau. Du chlorure de sodium est ajouté aux cellules externes pour remplacer ce qui a été hydrolysé.
Historique
Le premier brevet pour l'électrolyse d'une saumure a été accordé en Angleterre en 1851 à Charles Watt. Son procédé n'était pas une méthode économiquement faisable pour produire de l'hydroxyde de sodium car elle ne pouvait empêcher le chlore formé dans la une solution de saumure de réagir avec les autres constituants. Hamilton Castner résolu le problème de mélange grâce à l'invention de la cellule de mercure et a obtenu un brevet américain en 1892. Le chimiste autrichien, Karl Kellner arriva à une solution similaire à peu près en même temps. Afin d'éviter une bataille juridique, ils devinrent des partenaires en 1895, fondant la société Castner-Kellner Alkali Company, qui construit des usines employant le processus dans toute l'Europe. Le procédé à cellule de mercure continue à être utilisé à ce jour[3]. Cependant ce procédé est critiqué pour ses rejets de mercure dans l'environnement menant dans certains cas à de sévère intoxication au mercure[4]. À la suite de ces inquiétudes, les usines à cellule de mercure sont petit à petit supprimées, et un effort considérable est réalisé pour réduire les émissions de mercure des usines existantes[5].
Notes et références
- Pauling, Linus; General Chemistry 1970 ed. pp. 539–541 Dover publishing
- (en) Trinder, Barrie Stuart; Stratton, Michael, Twentieth century industrial archaeology, Londres, E&FN Spon, , 80–81 p. (ISBN 0-419-24680-0)
- (en) Chemistry Chronicles
- (en) Chlorine Plants: Major, Overlooked Source of Mercury Pollution, Oceana
- (en) WCC Submission to United Nations Environment Program on Reduction of Mercury in the Chlor-alkali sector « Copie archivée » (version du 25 mai 2011 sur l'Internet Archive)
- Portail de la chimie