Pyrophosphate
Les pyrophosphates (appelés aussi diphosphates) sont l'anion (base conjuguée), les sels et les esters de l'acide pyrophosphorique.
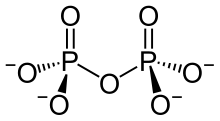
Les pyrophosphates sont constitués de deux molécules de phosphate condensées. Ils sont constitués autour d'une liaison P-O-P de type anhydride d'acide (formule semi-développée (O3P)–O–(PO3)4−). Les esters sont constitués autour d'une liaison de type C–O–P (formule semi-développée R–O–(PO2)–O–(PO3)3−).
Synthèse
Les pyrophosphates sont formés en chauffant des phosphates (hydrogénophosphates) ; ils tirent ainsi leur nom de cette origine (le préfixe pyro en grec signifiant feu).
Exemples de pyrophosphates
| Nom | Formule | Autre nom |
|---|---|---|
| dihydrogénopyrophosphate de disodium | Na2H2P2O7 | E 450i |
| hydrogénopyrophosphate de trisodium | Na3HP2O7 | E 450ii |
| pyrophosphate de tétrasodium (pyrophosphate de sodium) | Na4P2O7 | E 450iii |
| Nom | Formule |
|---|---|
| pyrophosphate de diméthylallyle |  |
| adénosine diphosphate |  |
Rôle biochimique
Les pyrophosphates ont un rôle majeur dans les processus de transfert d'énergie dans les cellules vivantes. Les anions pyrophosphates inorganiques HP2O73−, abrégés en PPi à l'instar des phosphates inorganiques, sont par exemple formés par l'hydrolyse de l'ATP en AMP :
- ATP + H20 → AMP + PPi + H+ (ΔG˚ = −45.6 kJ/mol)
Utilisation
Les pyrophosphates sont parfois utilisés comme arômes dans l'industrie de la nourriture pour chats, dans la mesure où ces derniers sont instinctivement très attirés par ces substances.
- Portail de la chimie
- Portail de la biochimie