Réaction de Balz-Schiemann
La réaction de Balz-Schiemann, ou réaction de Schiemann, est une réaction chimique de substitution où un groupe amine aromatique est remplacé par un fluor.
Elle a été découverte en 1927 par le chimiste allemand Günther Balz et améliorée par son collègue Günther Schiemann[1],[2]. Elle a été la première voie de synthèse des fluorobenzènes. Toutefois la réaction a été utilisée assez tardivement (vers les années 1980) à l'échelle industrielle en tant que voie de synthèse pour la fluoration des composés aromatiques[2].
Mécanisme
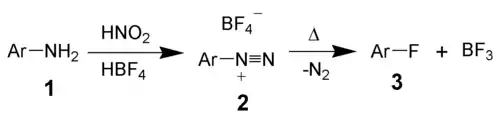
Le réactif initial est l'aniline (1) qui est transformée en sel diazonium par l'action de nitrite de sodium et d'acide chlorhydrique à basse température (<10 °C)[2]. Le sel est soluble dans l'eau. L'ajout d'acide fluoroborique ou d'une solution de tétrafluoroborate de sodium conduit à la formation du tétrafluoroborate d'arènediazonium (2) qui précipite. Le solide est filtré, lavé à l'éthanol, puis séché. L'élimination des traces de chlorure de sodium est importante pour éviter la formation ultérieure de chlorobenzènes et le séchage pour éliminer l'eau dont la présence peut conduire à la formation de phénol[2].
La dédiazonation se déroule par la décomposition du sel par la chaleur. Le solide est chauffé jusqu'à 200 °C et les produits de décomposition sont le diazote et le trifluorure de bore. La réaction est exothermique et doit être soigneusement contrôlée, le sel peut être mélangé à un diluant inerte tel du sable ou des paraffines. Le trifluorure de bore est récupéré par lavage des gaz de décomposition avec une solution d'acide fluorhydrique, ce qui permet de générer l'acide fluoroborique utilisé dans la deuxième étape du procédé. Le produit (3) est ensuite purifié par distillation[2].
La réaction conduit à de bons rendements à condition que les sels intermédiaires soient insolubles dans l'eau: d'un rendement excédent 90 % pour les sels insolubles, il peut descendre à 40 % pour les composés aromatiques comportant des groupes hydroxyles ou carboxyliques[2].
La réaction est similaire à la réaction de Sandmeyer utilisée pour synthétiser des halogénures d'aryle à partir de sels de diazonium.
Modifications
Le procédé original présentant plusieurs points faibles, notamment du point de vue de la sécurité, diverses modifications ont été proposées: utilisation de tétrafluoroborate de nitrosonium ou d'esthers de nitrite pour la formation de sels de tétrafluoroborate, ou encore d'acide hexafluorophosphorique qui forme des sels hexafluorophosphate d'arènediazonium peu solubles dans l'eau[3]. L'étape de décomposition peut être catalysée par du cuivre ou des halogénures de cuivre (variante Bergmann de la réaction de Balz-Schiemann) ou encore initiée par des procédés photochimiques ou ultrasoniques[3].
Notes et références
- (de) G. Balz et G. Schiemann, « Über aromatische Fluorverbindungen, I.: Ein neues Verfahren zu ihrer Darstellung », Ber. Dtsch. Chem. Ges., vol. 60, no 5, , p. 1186–1190 (ISSN 0365-947X, DOI 10.1002/cber.19270600539).
- (en) R. E. Banks, B. E. Smart et al., Organofluorine Chemistry: Principles and Commercial Applications, New York, NY, Plenum Press, coll. « Topics in Applied Chemistry », , 644 p. (ISBN 9781489912046 et 9781489912022, DOI 10.1007/978-1-4899-1202-2), chap. 9 (« Industrial Routes to Ring-Fluorinated Aromatic Compounds »), p. 203-207.
- (en) M. Hudlicky et A. E. Pavlath, Chemistry of Organic Fluorine Compounds II: A Critical Review, Washington, DC, American Chemical Society, coll. « ACS Monograph » (no 187), , 1296 p. (ISBN 9780841225152), « Replacement of Nitrogen by Fluorine », p. 271-278.
- Portail de la chimie