Réaction de Gabriel
La réaction de Gabriel, nommée en l'honneur du chimiste allemand Siegmund Gabriel[1], permet de synthétiser des amines primaires à partir d'un ion phtalimide et d'un halogénure d'alkyle primaire ou secondaire (un halogénométhane peut aussi être employé)[2]. L'ion phtalimide peut être acheté commercialement sous forme de sel ou généré in situ à partir de phtalimide et d'une base forte tel l'hydroxyde de potassium.
Mécanisme
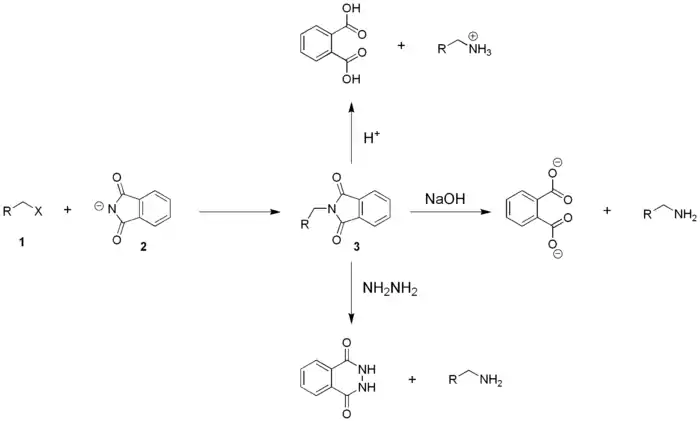
La première étape de la réaction est la déprotonation de l'imide. L'atome d'hydrogène de la fonction imide présente un caractère assez acide. L'anion imidure, base conjuguée de l'acide imide, est stabilisé par effet mésomère, dû à la présence des deux groupes carbonyle électrophiles liés à l'atome d'azote. Le phtalimide peut donc être facilement déprotonné. Il forme des sels avec différents cations métalliques, tels que les ions potassium et sodium. Ces sels peuvent être obtenus par réaction avec les carbonates métalliques correspondants. Le pthalimidure de potassium peut être synthétisé en faisant réagir le phtalimide avec le carbonate de potassium dans l'eau à 100 °C, ou par réaction du phtalimide avec une solution alcoolique d'hydroxyde de potassium.
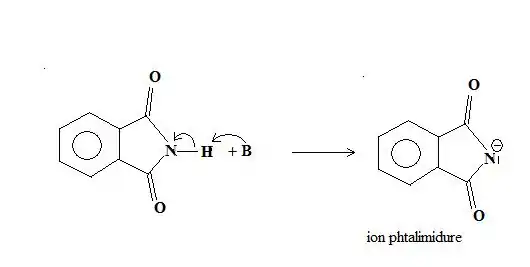
Le produit obtenu est peu basique (moins que les amidures), mais est un bon nucléophile. Il réagit avec les composés organiques halogénés, dans une réaction de substitution nucléophile bimoléculaire, de type SN2. La réaction est assez lente, mais est accélérée par chauffage et l'utilisation d'un solvant polaire aprotique, tel que le diméthylformamide (DMF).
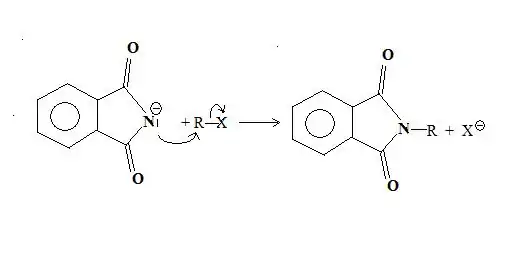
L'atome d'azote du N-alkylphtalimide obtenu est très peu nucléophile, à cause de la présence des deux groupements carbonyle. Il n'a donc pas tendance à donner de substitution nucléophile avec une seconde molécule d'halogénure. Du coup, on évite la polyalkylation, qui est le principal inconvénient de la réaction d'Hofmann.
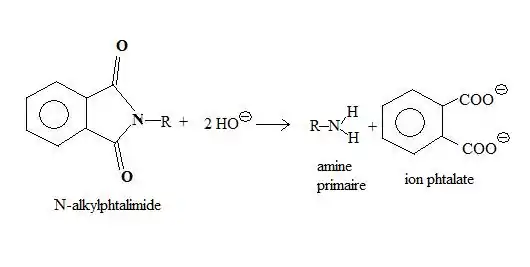
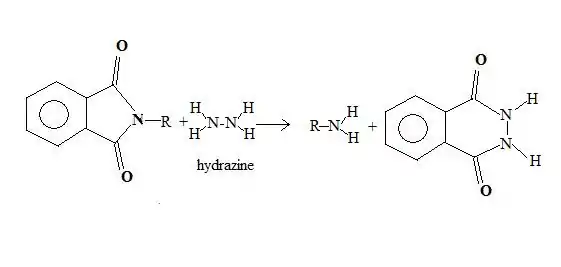
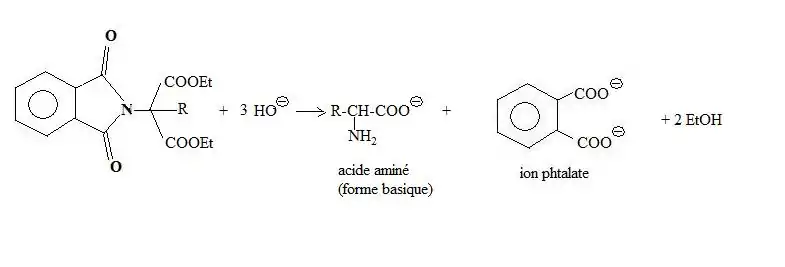
L'hydrolyse de l'intermédiaire réactionnel, en milieu basique concentré, conduit à la formation d'une amine, l'ion benzène-1,2-dioate (phtalate) étant obtenu comme sous-produit[3].
Le chauffage, nécessaire lors de la dernière étape, conduit à une dégradation importante des produits. Ing et Manske ont mis au point une variante[4], dans laquelle la base utilisée pour la dernière étape est l'hydrazine, qui agit à température ambiante, et évite les pertes de l'hydrolyse à chaud.
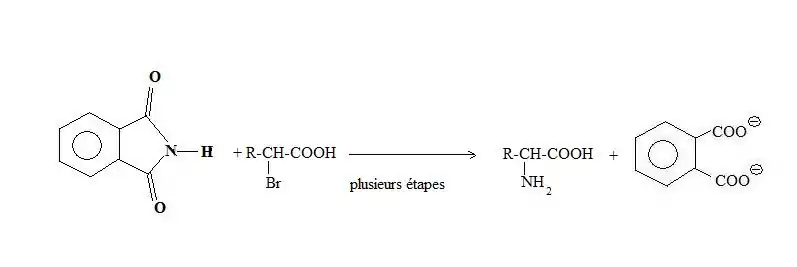
Synthèse des α-amino-acides
Les acides α-aminés peuvent être synthétisés par la réaction de Gabriel du phtalimide avec l'acide α-bromé correspondant.
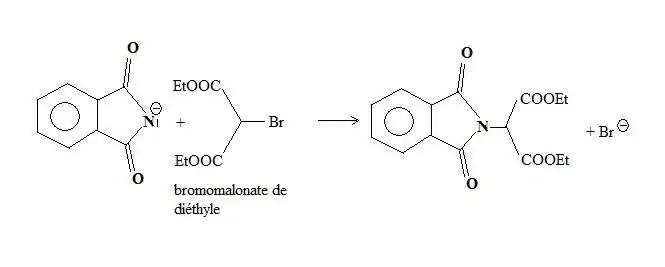
L'utilisation, comme réactif halogéné, du 2-bromopropane-1,3-dioate d'éthyle (bromomalonate d'éthyle) permet une synthèse de nombreux acides α-aminés.
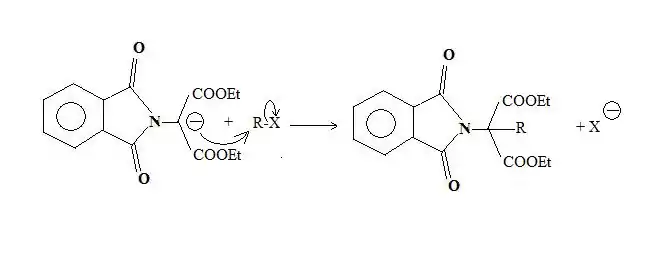
L'imidure est d'abord alkylé par l'ester bromomalonique.
L'alkylimide porte un hydrogène acide, en α de l'azote, qui est facilement arraché par une base, généralement l'ion éthanolate.
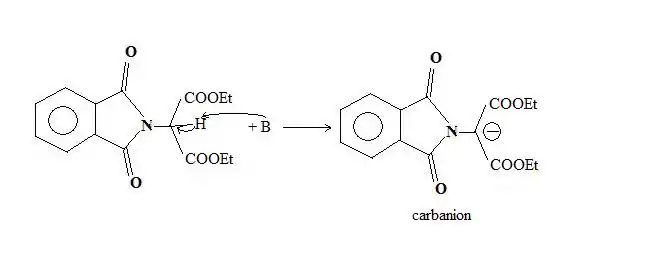
Le carbanion ainsi formé est alors utilisé comme nucléophile, lors d'une réaction de substitution nucléophile sur un composé organique halogéné. C'est à cette étape que l'on introduit le reste R de l'acide α-aminé.
L'hydrolyse basique conduit enfin à la base conjuguée de l'acide α-aminé.
Avec ce réactif, la synthèse de Gabriel de l'acide aminométhanoïque (glycine) a un rendement de 85 %.
Références
- (de) S. Gabriel, « Ueber eine Darstellungsweise primärer Amine aus den entsprechenden Halogenverbindungen », Ber. Dtsch. Chem. Ges., vol. 20, no 2, , p. 2224–2236 (ISSN 0365-9496, DOI 10.1002/cber.18870200227, lire en ligne).
- T. W. G. Solomons et C. B. Fryhle (trad. N. Voyer), Chimie organique, Mont-Royal (Québec), Modulo, , 7e éd., 1151 p. (ISBN 978-2-89113-798-0), p. 846.
- (en) J. J. Li et E. J. Corey, Name reactions for functional group transformations, Hoboken, NJ, John Wiley & Sons, , 753 p. (ISBN 978-0-471-74868-7 et 9780470176511, DOI 10.1002/9780470176511), chap. 5 (« Amine Synthesis »), p. 438-439.
- (en) H. R. Ing et R. H. L. Manske, « A modification of the Gabriel synthesis of amines », J. Chem. Soc., vol. 129, , p. 2348-2351 (ISSN 0368-1769, DOI 10.1039/JR9262902348).
- Portail de la chimie