Réaction de Peterson
La réaction de Peterson, ou oléfination de Peterson, est une réaction d'oléfination entre un carbanion α-silyle (1) et une cétone ou un aldéhyde pour former un β-hydroxysilane (2) qui donne un alcène (3) par élimination[1] :
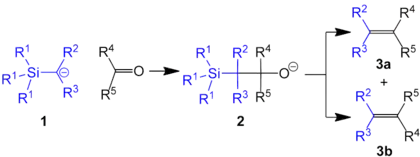
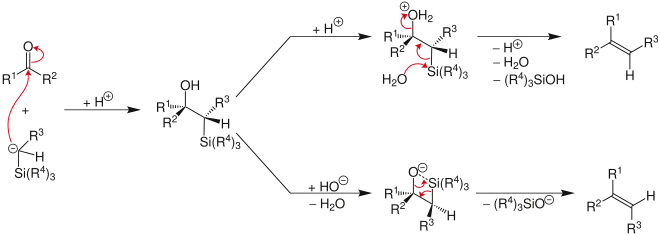
Il s'agit d'une réaction importante en synthèse organique car elle permet la formation diastéréosélective d'alcènes cis ou trans à partir d'un intermédiaire β-hydroxysilanes ; le traitement acide (ci-dessous en haut) ou basique (en bas) de ce dernier donne en effet des alcènes de stéréochimie opposée :
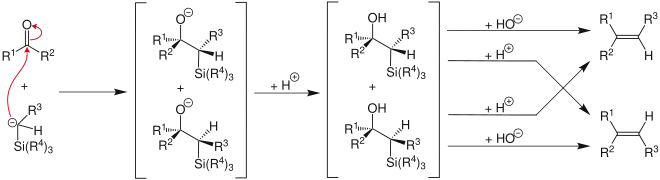
Dans la mesure où deux stéréoisomères différents peuvent se former lors de la première étape pouvant chacun être traités de deux manières différentes, il existe quatre voies de réaction possibles :
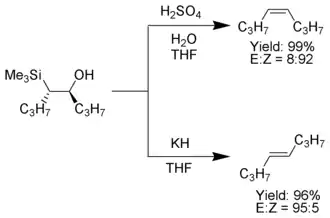
Lorsque le carbanion α-silyle ne porte que des substituants alkyle, hydrogène ou donneurs d'électrons, il est possible de contrôler l'orientation stéréochimique du produit de la réaction[2] car cette dernière se déroule lentement à basse température, ce qui permet d'isoler le β-hydroxysilane intermédiaire et de le traiter de manière appropriée avec un acide ou une base pour obtenir le produit souhaité[3] :
Lorsque le carbanion α-silyle porte des substituants accepteurs d'électrons, la réaction de Peterson forme directement un alcène, de sorte que l'intermédiaire β-hydroxysilane ne peut être isolé.
Notes et références
- (en) Donald John Peterson, « Carbonyl olefination reaction using silyl-substituted organometallic compounds », The Journal of Organic Chemistry, vol. 33, no 2, , p. 780-784 (DOI 10.1021/jo01266a061, lire en ligne)
- (en) Anthony G. M. Barrett, John A. Flygare, Jason M. Hill et Eli M. Wallace, « Stereoselective Alkene Synthesis via 1-Chloro-1-[(Dimethyl)Phenylsilyl]Alkanes and α-(Dimethyl)Phenylsilyl Ketones: 6-Methyl-6-Dodecene », Organic Syntheses, vol. 73, , p. 50 (DOI 10.15227/orgsyn.073.0050, lire en ligne)
- (en) David J. Ager, « The Peterson Olefination Reaction », Organic Reactions, (DOI 10.1002/0471264180.or038.01, lire en ligne)
- Portail de la chimie