Réduction de Wolff-Kishner
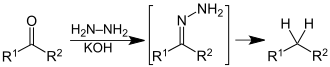
En chimie organique, la réduction de Wolff-Kishner permet la réduction d'un groupement carbonyle en hydrocarbure saturé en deux étapes. La condensation du groupement carbonyle avec de l'hydrazine permet la formation d'une hydrazone intermédiaire, qui est ensuite déprotonée sous l'action d'une base forte (NaOH, KOH, NaOEt…) pour conduire à l'hydrocarbure saturé attendu.
Pour les articles homonymes, voir Wolff.
Historique
Cette réaction a été découverte indépendamment par le russe Nikolai Kischner (en)[1] et l'allemand Ludwig Wolff[2], respectivement en 1911 et 1912.
La procédure standard a longtemps préconisé l'emploi d'hydrazine pure dans un solvant à haut point d'ébullition, tel que l'éthylène glycol, en présence d'un large excès de base (NaOH, NaOEt, etc.), le milieu réactionnel étant chauffé à reflux pendant plusieurs jours[3],[4],[5]. Cette méthode est donc intéressante pour des molécules stables thermiquement et insensibles aux conditions très basiques, et présente donc un intérêt limité en synthèse organique.
Afin de faciliter la mise en œuvre de cette réaction, de nouvelles conditions ont été développées par plusieurs groupes de recherche. Ainsi, l'élimination après la première étape de l'eau et de l'excès d'hydrazine par distillation a permis d'augmenter la température de la seconde étape à presque 200 °C, réduisant ainsi considérablement le temps de réaction (3-6h)[6]. Cette approche conduit à de meilleurs rendements, et autorise l'emploi d'hydrate d'hydrazine et de bases hygroscopiques (NaOH et KOH). Une méthode plus douce repose sur l'addition de l'hydrazone préformée dans une solution de tert-butylate de potassium dans le DMSO[7]. Bien que la réduction soit alors possible à température ambiante, il a été montré que cette réaction était difficile à mettre en pratique sur petite échelle et qu'elle était très dépendante du substrat.
Enfin, une nouvelle modification des conditions de Wolff-Kishner a été proposée, permettant la réduction de groupements carbonyles avec une très bonne chimiosélectivité[8]. La cétone est tout d'abord convertie en N-TBS-hydrazone en présence d'un acide de Lewis à température ambiante, puis une solution de tert-butylate de potassium/tert-butanol dans le DMSO est ajoutée, ce qui provoque la réduction de l'hydrazone en alcane.
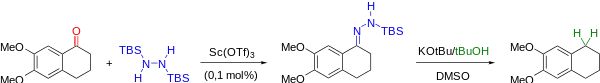
Les hydrazones intermédiaires ont pu être synthétisées de manière chimiosélective, puis purifiées par colonne chromatographique sur silice (désactivée avec de la triéthylamine). Les auteurs ont également démontré l'efficacité de cette méthodologie pour la réduction de molécules aliphatiques, aromatiques ou polycycliques complexes avec de très bons rendements.
Mécanisme
En présence d'ions H+, la cétone est convertie en hydrazone, il se forme une imine. Le traitement à l'aide d'une base forte (ici la potasse) va alors permettre la déprotonation de l'hydrazone, suivie de la protonation du carbone en présence d'une molécule d'eau. La répétition de cette séquence va conduire à la génération de l'hydrocarbure attendu (CH2) et à la libération d'une molécule de diazote, rendant cette réaction irréversible.

Articles liés
Références
- Kishner, N. J. Russ. Phys. Chem. Soc. 1911, 43, 582.
- (de) Ludwig Wolff et R. Krüche, « Über Diazoanhydride (1,2,3-Oxydiazole oder Diazoxyde) und Diazoketone », Justus Liebig's Annalen der Chemie, vol. 394, no 1, , p. 23-59 (DOI 10.1002/jlac.19123940104)
- Todd, D. Wolff-Kishner reduction. Org. React. 1948, 4, 378-422, DOI:10.1002/0471264180.or004.08.
- Ng. Ph. Buu-hoï, Ng. Hoán et Ng. D. Xuong, « Les Limitations de la Réaction de Kishner-Wolff », Recueil des Travaux Chimiques des Pays-Bas, vol. 71, no 3, , p. 285-291 (DOI 10.1002/recl.19520710309)
- Alan R. Katritzky, Otto. Meth-Cohn et Charles W. (Charles Wayne) Rees, Comprehensive organic functional group transformation, Oxford, OX ; New York, Pergamon, (ISBN 0-08-040604-1), p. 327-362
- (en) Huang-Minlon, « A Simple Modification of the Wolff-Kishner Reduction », Journal of the American Chemical Society, vol. 68, no 12, , p. 2487-2488 (DOI 10.1021/ja01216a013)
- (en) Donald J. Cram et Melville R. V. Sahyun, « Room Temperature Wolff-Kishner Reduction and Cope Elimination Reactions », Journal of the American Chemical Society, vol. 84, no 9, , p. 1734-1735 (DOI 10.1021/ja00868a048)
- (en) Michael E. Furrow et Andrew G. Myers, « Practical Procedures for the Preparation of N-tert-Butyldimethylsilylhydrazones and Their Use in Modified Wolff−Kishner Reductions and in the Synthesis of Vinyl Halides and gem-Dihalides », Journal of the American Chemical Society, vol. 126, no 17, , p. 5436-5445 (DOI 10.1021/ja049694s)
Bibliographie
Ouvrages utilisés pour la rédaction de l'article
(en) László Kürti et Barbara. Czakó, Strategic applications of named reactions in organic synthesis : background and detailed mechanism, Amsterdam ; Boston, Elsevier Academic Press, , 758 p. (ISBN 0-12-429785-4)
Articles connexes
- (en) L. Caglioti et M. Magi, « The reaction of tosylhydrazones with lithium aluminium hydride », Tetrahedron, vol. 19, no 7, , p. 1127-1131 (DOI 10.1016/S0040-4020(01)98571-0)
- Portail de la chimie