RAB7A
La protéine Rab-7a apparentée à Ras ou RAB7A (en anglais : Ras-related protein Rab-7a) est une protéine qui, chez l'homme, est codée par le gène RAB7A[2],[3].
| RAB7A | ||

| ||
| Caractéristiques générales | ||
|---|---|---|
| Nom approuvé | Ras-related protein Rab-7a | |
| Homo sapiens | ||
| Locus | 3q13.1 | |
| Nombre de résidus | 207 acides aminés[1] | |
La protéine Rab-7a associée à Ras est impliquée dans l'endocytose, qui est un processus qui introduit des substances dans une cellule. Le processus d'endocytose fonctionne en repliant la membrane cellulaire autour d'une substance à l'extérieur de la cellule (par exemple une protéine), puis forme une vésicule. La vésicule est ensuite introduite dans la cellule et clivée de la membrane cellulaire. RAB7A joue un rôle important dans le mouvement des vésicules dans la cellule ainsi que dans le trafic de vésicules[4].
Diverses mutations de RAB7A sont associées à la neuropathie héréditaire sensorielle de type 1C (HSN IC), également connue sous le nom de syndrome de Charcot-Marie-Tooth de type 2B (CMT2B)[5].
Fonction

Les membres de la famille RAB de protéines de liaison au GTP liées à RAS sont d'importants régulateurs du transport vésiculaire et sont situés dans des compartiments intracellulaires spécifiques. RAB7 a été localisé dans les endosomes tardifs et s'est révélé important dans la voie endocytaire tardive. De plus, il s'est avéré avoir un rôle fondamental dans la vacuolation cellulaire induite par la cytotoxine VacA de Helicobacter pylori[6].
RAB7A fonctionne comme un régulateur clé dans le trafic endo-lysosomal, régit la maturation endosomique précoce à tardive, la migration et les positions endosomales dirigées vers l'extrémité plus et vers l'extrémité plus, et le transport endosome-lysosome à travers différentes cascades d'interaction protéine-protéine.
RAB7A est également impliqué dans la régulation de certains trafics de membrane endosomale spécialisés, tels que la maturation des mélanosomes par la modulation de SOX10 et de l'oncogène MYC. Des mutations dans la voie lysosomale entraînent une progression tumorale dans les cellules de mélanome.
Distribution tissulaire
RAB7 est largement exprimé ; on trouve une expression élevée dans le muscle squelettique[7] car elle joue un rôle dans le transport rétrograde à longue distance des endosomes de signalisation dans les axones.
Gène
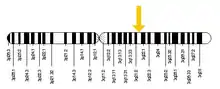
Le gène RAB7A est situé sur le chromosome 3 chez l'homme, en particulier sur le bras q long de la paire de bases 128 726 135 à 128 814 797. L'endroit a été trouvé à l'aide d'une cartographie qui a d'abord été réalisée par Davies et al. en 1997 pour cartographier le gène RAB7A sur le chromosome 3 en utilisant une analyse PCR[2]. En 1995, il avait été cartographié sur le chromosome 9 chez la souris par Barbosa et al. Enfin, en utilisant l'hybridation in situ par fluorescence (FISH), Kashuba et al. ont pu cartographier le gène RAB7A en 3q21 en 1997[3].
RAB7a a été cloné en criblant une bibliothèque d'ADNc de placenta humain avec un ADNc Rab7 de rat pour montrer que l'ADNc de RAB7a code une protéine de 207 acides aminés dont la séquence est 99% identique à celle de Rab7a de souris, de rat et de chien et 61% identique à celle de levure Rab7a. En utilisant l'analyse Northern Blot, Vitelli et al. (1996) ont constaté que RAB7a était exprimé sous forme de transcrits de 1,7 et 2,5 kb dans toutes les lignées cellulaires examinées, mais qu'il y avait une grande différence dans la quantité totale d'ARNm de RAB7a parmi les lignées cellulaires[8].
Régulation

Il a été démontré que les niveaux et la fonction de RAB7a étaient indépendants des facteurs de transcription spécifiques à la lignée mélanocytaire (MITF), mais des recherches récentes ont montré que SOX10 (un maître modulateur neuroectodermique) et MYC (un oncogène) sont les principaux régulateurs. Rab7a est réglementé par SOX10 et MYC respectivement dans un câblage spécifique à la lignée. Des études montrent que le RAB7a peut être spécifiquement régulé à la hausse par des manières indépendantes du MITF comme le changement des niveaux de SOX10 ou de MYC pour affecter la prolifération tumorale, en particulier dans le mélanome[réf. nécessaire].
Dans les études utilisant l'ARN antisens, la régulation négative de l'expression du gène RAB7 dans les cellules HeLa utilisant l'ARN antisens induit une vacuolisation cellulaire sévère qui ressemble au phénotype observé dans les fibroblastes de patients atteints du syndrome de Chédiak – Higashi[9].
En présence de facteur de croissance, l'inhibition du facteur de croissance de Rab7 de mammifère n'a eu aucun effet sur l'expression du transporteur de nutriments dans les cellules lymphocytaires pro-B de souris. Dans les cellules privées de facteur de croissance, cependant, le blocage de la fonction Rab7 a empêché la clairance du glucose et des protéines de transport des acides aminés de la surface cellulaire. Lorsque Rab7 a été inhibé, les cellules privées de facteur de croissance ont maintenu leur potentiel de membrane mitochondriale et ont affiché une survie cellulaire prolongée, indépendante du facteur de croissance et dépendante des nutriments. Les auteurs ont conclu que RAB7 fonctionne comme une protéine proapoptotique en limitant l'absorption des nutriments autonomes par les cellules[10].
Interactions
Il a été démontré que RAB7A interagit avec RILP[11],[12] et CHM[13],[14]. Il a été démontré que la RILP joue un rôle clé dans le contrôle du transport vers les compartiments dégradants avec Rab7 et peut lier la fonction de Rab7 au cytosquelette. RILP joue le rôle d'un effecteur en aval pour Rab7 et ensemble ces deux protéines agissent pour réguler le trafic endocytaire tardif[15].
Les autres interactions clés comprennent RAC1 (par similitude), NTRK1 / TRKA (par similitude), C9orf72 (par similitude), CHM (la sous-unité de liaison au substrat du complexe Rab geranylgeranyltransférase), et RILP[16], ainsi que PSMA7, RNF115 et FYCO1. Interagit avec le complexe PIK3C3 / VPS34-PIK3R4. Le formulaire lié au GTP interagit avec OSBPL1A et CLN3[17]. Il a également été démontré que Rab7A interagit avec le complexe Retromer, très probablement via la sous-unité Vps35[18].
Signification clinique
RAB7 est une petite GTPase qui a le potentiel de provoquer une tumeur maligne de plus de 35 types de tumeurs. On constate que RAB7 est un conducteur de mélanome induit précoce dont les niveaux peuvent définir le risque métastatique. Le gène RAB7A appartient à la famille de gènes RAB, qui fait partie de la famille des oncogènes RAS. Ces gènes de la famille RAB fournissent les instructions nécessaires à la fabrication de protéines pour le trafic de vésicules. Ces protéines sont des GTPases et agissent comme un interrupteur qui est activé et désactivé par les molécules GTP et GDP[4].
Mélanome
Les cellules de mélanome conservent une mémoire de développement qui reflète un câblage unique des voies de trafic des vésicules. Rab7 est considéré comme contrôlant le potentiel prolifératif et invasif de ces tumeurs agressives lors de l'identification d'un groupe de gènes endolysosomaux enrichis en mélanome. La dégradation associée aux lysosomes, une caractéristique universelle des cellules eucaryotes, peut être détournée d'une manière dépendante du type de tumeur et du stade. Trouver que RAB7 est contrôlé par SOX10 et MYC de manière indépendante du MITF a des implications fondamentales et translationnelles importantes[19]. Sox10 n'est pas inhibé par des mécanismes qui régulent à la baisse le MITF, dont certains incluant des mutations BRAF, sont relativement fréquents dans les mélanomes malins. Cela peut assurer une mémoire de développement dans l'expression de RAB7. On suppose que la régulation à la baisse de RAB7 dans le front invasif des mélanomes agressifs est modulée par des mécanismes de type épithélial à mésenchymateux, tels que ceux récemment décrits comme étant à la base du commutateur transcriptionnel associé aux phénotypes prométastatiques. En d'autres termes, il existe une dépendance inhérente des cellules de mélanome à la petite GTPase RAB7, identifiée au sein d'un groupe de gènes lysosomaux qui distingue cette tumeur maligne de plus de 35 types de tumeurs. Des analyses dans des cellules humaines, des échantillons cliniques et des modèles de souris ont démontré que RAB7 est un conducteur de mélanome induit précocement dont les niveaux peuvent être réglés pour favoriser l'invasion tumorale, définissant finalement le risque métastatique. Il est important de noter que les niveaux et la fonction du RAB7 étaient indépendants du MITF et que le modulateur maître neuroectodermique SOX10 et l'oncogène MYC sont des régulateurs clés du RAB7a.
Charcot-Marie-Tooth 2B

Également connue sous le nom de neuropathie Charcot – Marie – Tooth, neuropathie héréditaire motrice et sensorielle (HMSN) et atrophie musculaire péronière (PMA). Il s'agit d'un groupe génétiquement et cliniquement hétérogène de troubles héréditaires, caractérisé par une perte sensorielle importante, souvent compliquée par des ulcéro-mutilations graves des orteils ou des pieds, et une implication motrice variable[20],[21]. Des mutations faux-sens dans RAB7A, le gène codant la petite GTPase Rab7, provoquent CMT2B et augmentent l'activité de Rab7. Rab7 est exprimé de manière omniprésente et est impliqué dans la dégradation par la voie lysosomale. Actuellement incurable, cette maladie est l'un des troubles neurologiques héréditaires les plus courants, touchant environ 1 personne sur 2 500, soit environ 23 000 personnes au Royaume-Uni et 125 000 personnes aux États-Unis. La CMT était auparavant classée comme un sous-type de dystrophie musculaire[22].
Références
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- « Cloning and mapping of human Rab7 and Rab9 cDNA sequences and identification of a Rab9 pseudogene », Genomics, vol. 41, no 1, , p. 131–4 (PMID 9126495, DOI 10.1006/geno.1997.4644)
- « NotI linking/jumping clones of human chromosome 3: mapping of the TFRC, RAB7 and HAUSP genes to regions rearranged in leukemia and deleted in solid tumors », FEBS Letters, vol. 419, nos 2–3, , p. 181–5 (PMID 9428630, DOI 10.1016/S0014-5793(97)01449-X)
- « RAB7A Genetics Home Reference », U.S. National Library of Medicine (consulté le )
- « Hereditary sensory neuropathy type I », Orphanet Journal of Rare Diseases, vol. 3, no 7, , p. 7 (PMID 18348718, PMCID 2311280, DOI 10.1186/1750-1172-3-7, lire en ligne)
- « Entrez Gene: RAB7A RAB7A, member RAS oncogene family »
- « Mutations in the small GTP-ase late endosomal protein RAB7 cause Charcot-Marie-Tooth type 2B neuropathy », American Journal of Human Genetics, vol. 72, no 3, , p. 722–727 (PMID 12545426, PMCID 1180247, DOI 10.1086/367847)
- « Molecular cloning and expression analysis of the human Rab7 GTP-ase complementary deoxyribonucleic acid », Biochemical and Biophysical Research Communications, vol. 229, no 3, , p. 887–890 (PMID 8954989, DOI 10.1006/bbrc.1996.1897)
- « Cloning and mapping of human Rab7 and Rab9 cDNA sequences and identification of a Rab9 pseudogene », Genomics, vol. 41, no 1, , p. 131–134 (PMID 9126495, DOI 10.1006/geno.1997.4644)
- « Rab7 prevents growth factor-independent survival by inhibiting cell-autonomous nutrient transporter expression », Developmental Cell, vol. 5, no 4, , p. 571–82 (PMID 14536059, DOI 10.1016/s1534-5807(03)00291-0)
- « Rab-interacting lysosomal protein (RILP): the Rab7 effector required for transport to lysosomes », The EMBO Journal, vol. 20, no 4, , p. 683–93 (PMID 11179213, PMCID 145419, DOI 10.1093/emboj/20.4.683)
- « Human Vam6p promotes lysosome clustering and fusion in vivo », The Journal of Cell Biology, vol. 154, no 1, , p. 109–22 (PMID 11448994, PMCID 2196876, DOI 10.1083/jcb.200102142)
- « Crystallization and preliminary X-ray diffraction analysis of monoprenylated Rab7 GTPase in complex with Rab escort protein 1 », Journal of Structural Biology, vol. 141, no 1, , p. 93–5 (PMID 12576024, DOI 10.1016/S1047-8477(02)00634-2)
- « Moderate discrimination of REP-1 between Rab7 x GDP and Rab7 x GTP arises from a difference of an order of magnitude in dissociation rates », FEBS Letters, vol. 425, no 3, , p. 460–4 (PMID 9563513, DOI 10.1016/S0014-5793(98)00290-7)
- « Structural basis for recruitment of RILP by small GTPase Rab7 », The EMBO Journal, vol. 24, no 8, , p. 1491–1501 (PMID 15933719, PMCID 1142575, DOI 10.1038/sj.emboj.7600643)
- « A unique region of RILP distinguishes it from its related proteins in its regulation of lysosomal morphology and interaction with Rab7 and Rab34 », Molecular Biology of the Cell, vol. 15, no 2, , p. 815–826 (PMID 14668488, PMCID 329395, DOI 10.1091/mbc.E03-06-0413)
- « Neuronal ceroid lipofuscinosis protein CLN3 interacts with motor proteins and modifies location of late endosomal compartments », Cellular and Molecular Life Sciences, vol. 69, no 12, , p. 2075–2089 (PMID 22261744, DOI 10.1007/s00018-011-0913-1)
- « Regulation of retromer recruitment to endosomes by sequential action of Rab5 and Rab7 », The Journal of Cell Biology, vol. 183, no 3, , p. 513–26 (PMID 18981234, PMCID 2575791, DOI 10.1083/jcb.200804048)
- « RAB7 controls melanoma progression by exploiting a lineage-specific wiring of the endolysosomal pathway », Cancer Cell, vol. 26, no 1, , p. 61–76 (PMID 24981740, DOI 10.1016/j.ccr.2014.04.030)
- « Physical Medicine and Rehabilitation for Charcot-Marie-Tooth Disease », Medscape (consulté le )
- « Neurological dysfunction and axonal degeneration in Charcot-Marie-Tooth disease type 1A », Brain, vol. 123, no 7, , p. 1516–27 (PMID 10869062, DOI 10.1093/brain/123.7.1516)
- « Human Rab7 mutation mimics features of Charcot-Marie-Tooth neuropathy type 2B in Drosophila », Neurobiology of Disease, vol. 65, , p. 211–9 (PMID 24521780, DOI 10.1016/j.nbd.2014.01.021)
Liens externes
- Portail de la biologie cellulaire et moléculaire
- Portail de la biochimie
- Portail de la médecine