Rendement de Faraday
Le rendement de Faraday (rf) (ou Efficacité de Coulomb) est le rapport entre la quantité de gaz produite et la quantité de gaz théoriquement produite lors d'une électrolyse.
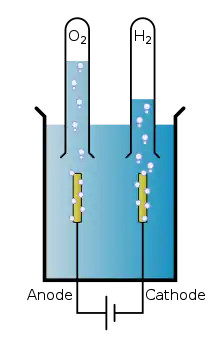
Principe de l'électrolyse
L'électrolyse permet de décomposer une molécule de dihydrogène en deux ions H+ et deux électrons e− au contact d'une anode. Les électrons vont circuler de l'anode vers la cathode créant un courant électrique. L'anode permet l'oxydation (perte d’électrons), borne + ; la cathode permet la réduction (gain d’électrons), borne −. Puis les ions H+ traversent un électrolyte (matériau bloquant le passage des électrons) et se ré-associent deux par deux avec deux électrons et un atome d'oxygène provenant de l'air. Cette réaction s'effectue au niveau de la cathode.
Réaction à l'anode (oxydation) :
- H2 → 2H+ + 2e−
Réaction à la cathode (réduction) :
- 4H+ + O2 + 4e− → 2H2O
La réaction existe aussi pour décomposer l'eau :
Réaction à l'anode :
- 2(H2O)l → O2g + 4H+aq + 4e−
Réaction à la cathode :
- 4(H2O)l + 4e− → 2(H2)g + 4(OH−)aq
Calcul du volume théorique
Pour déterminer ce rendement, on doit mesurer le volume d'hydrogène produit et l'énergie électrique utilisée pour produire cette quantité.
On utilise la formule suivante : PV = n·R·T
avec :
- V : volume de gaz théoriquement produit en m3 ;
- n : nombre de moles de H2 créées ;
- P : pression ambiante : 1,013×105 Pa ;
- R : constante universelle des gaz parfaits : 8,314 J·mol-1·K-1 ;
- T : température ambiante en K.
Cette formule permet de calculer le volume d'H2, on utilise pour cela la constante de Faraday (F) : n = I·t/F, où n est le nombre de moles d'électrons produites pendant la durée de la réaction, égal aux charges totales produites (intensité du courant I multipliée par la durée t) divisées par la charge globale d'une mole de charges élémentaires, F.
Pour générer une molécule d'H2, deux électrons sont mis en jeu car deux ions H+ interviennent ; le nombre de moles d'H2 vaut alors : n = I·t/(2F).
Donc le volume de gaz produit vaut : V = R·T·I·t/(2P·F).
Rendement de Faraday
Le rendement faradique vaut : rf = Vréel/Vthéorique
avec :
- Vréel : volume réel ;
- Vthéorique : volume calculé.
On peut calculer aussi le rapport entre la masse de matière produit et la masse de matière théorique pour une électrolyse.
Rendement énergétique
On peut utiliser le rendement de Faraday pour calculer le rendement énergétique (rW) avec la formule : rW = Wth/Wr
avec :
- énergie électrique théorique, Wth = rf·Eth·I·t, où Eth est la différence de tension électrique théorique ;
- énergie électrique réelle nécessaire pour produire ou consommer une quantité donnée d'espèce par électrolyse, Wr = Er·I·t, où Er est la différence de tension électrique entre les deux bornes.
Soit la formule complète : rW = rf·Eth·I·t/Er·I·t
donc :
- , où est le rendement de Faraday.
Sources
- « Notions élémentaires sur les cellules électrochimiques » [PDF]
- https://moodle.umons.ac.be/pluginfile.php/5907/mod_resource/content/1/Chapitre2_Lois_de_Faraday_.pdf
- http://bts.chimie.encpb.free.fr/12_13/TP/gene/TPG_05_Annexe_02.pdf
- http://physiquedaguin.free.fr/Tspe/production_dihydrogene/TP_production_dihydrogene.pdf
- https://www.edumedia-sciences.com/fr/media/713-electrolyse-de-leau
- Portail de la chimie