Repliement globine
Le repliement globine est un mode de repliement courant dans les protéines de la famille des globines ainsi que de la superfamille des protéines qui leur sont homologues. Il consiste généralement en une structure tridimensionnelle comprenant huit hélices α, bien que certaines protéines ajoutent quelques hélices supplémentaires à leurs extrémités[1]. On observe ce repliement dans les hémoglobines, les myoglobines ainsi que les phycocyanines. Ce fut le premier repliement protéique identifié, car la myoglobine a été la première protéine dont la structure tridimensionnelle a été résolue. Dans la mesure où cette structure ne contient que des hélices α, elle est classée comme repliement tout-α (en). Dans le cas des globines, les hélices α délimitent une cavité dans laquelle s'insère l'hème, qui est leur groupe prosthétique.
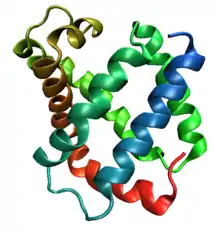
Si le repliement globine est hautement conservé à travers l'évolution, la séquence qui en est responsable peut être très variable et ne présenter qu'à peine 16 % d'identité au niveau des acides aminés. Plus importante est la conservation d'un cœur hydrophobe et d'une surface hydrophile assurant le repliement correct de la protéine. L'exemple le plus connu des effets d'une mutation substituant un résidu hydrophile à la surface de l'hémoglobine par un résidu hydrophobe est la drépanocytose : le glutamate est remplacé par la valine, qui est apolaire, c'est-à-dire hydrophobe, ce qui offre une zone d'adhérence à la surface de la protéine et déclenche sa précipitation dans certaines conditions.
Notes et références
- (en) Martino Bolognesi, Silvia Onesti, Giuseppina Gatti, Alessandro Coda, Paolo Ascenzi et Maurizio Brunori, « Aplysia limacina myoglobin: Crystallographic analysis at 1.6 Å resolution », Journal of Molecular Biology, vol. 205, no 3, , p. 529-544 (PMID 2926816, DOI 10.1016/0022-2836(89)90224-6, lire en ligne)
- Portail de la biochimie