Rofécoxib
Le rofécoxib est un médicament anti-inflammatoire non stéroïdien (AINS) de la classe des coxibs utilisé dans le traitement de l'ostéoarthrite, des états douloureux aigus, et de la dysménorrhée. Il est commercialisé sous les marques Vioxx© et Vioxx-Dolor©. Introduit en 1999 par la multinationale Merck Sharp & Dohme, il était disponible sur ordonnance en comprimés et suspension buvable. Rien qu'aux États-Unis, on estime que plus de 20 millions de personnes l'ont utilisé.
| Rofécoxib | |
| |
| Identification | |
|---|---|
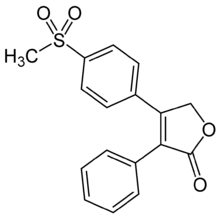
| Nom UICPA | 4-[4-(méthylsulfonyl)phényl]-3-phénylfuran-2(5H)-one |
| No CAS | |
| No ECHA | 100.230.077 |
| Code ATC | M01 |
| DrugBank | DB00533 |
| PubChem | 5090 |
| SMILES | |
| InChI | |
| Apparence | Solide |
| Propriétés chimiques | |
| Formule | C17H14O4S [Isomères] |
| Masse molaire[1] | 314,356 ± 0,021 g/mol C 64,95 %, H 4,49 %, O 20,36 %, S 10,2 %, |
| Propriétés physiques | |
| Solubilité | Insoluble dans l'eau |
| Unités du SI et CNTP, sauf indication contraire. | |
Il est retiré du marché en 2004 à cause d'un risque accru d'infarctus du myocarde (au niveau mondial le ).
Il a vite été avéré que le laboratoire Merck connaissait les effets secondaires potentiellement mortels avant même de lancer Vioxx en 1999, mais avait dissimulé les résultats inquiétants de ces études. Traduit en justice, Merck plaide coupable afin d’écourter le scandale et doit verser cinq milliards de dollars en 2005-2006 pour indemniser les victimes, puis verser, en 2011, 950 millions à l'Etat américain, pour « fausses déclarations sur la sécurité de son médicament aux fins d'augmenter ses ventes ».
Propriétés
Inhibiteur COX-2 sélectif
Comme toute molécule de cette classe, elle possède une action anti-inflammatoire et sensiblement avec moins d'effets indésirables gastrique (brûlures, ulcère), moins de saignements digestifs que les molécules plus anciennes, mais avec plus de risque de développer des maladies cardiovasculaires.
Contrairement à l'aspirine et aux anti inflammatoires non stéroïdiens classiques, elle ne modifie pas la sécrétion de Thromboxane A2. De plus, elle diminue le taux de prostacycline circulante, cette dernière étant vasodilatatrice. L'aggrégabilité plaquettaire est alors augmentée.
Effets secondaires
article principal : coxib
Scandale pharmaceutique, et retrait du marché
En dépit d'effets secondaires graves (surtout en cas de prise prolongée ou de terrain prédisposant) connus du fabricant, le Rofecoxib a été utilisé durant plusieurs années sans information des médecins et patients quant à ces effets. Les autres coxibs ne sont pas exempts des mêmes effets, même s'ils sont numériquement plus rares.
Étude de la FDA
Une étude de l'administration américaine des denrées alimentaires et des médicaments (Food & Drug Administration FDA) conclut que 27 785 décès et problèmes cardiaques pourraient avoir été causés par le Vioxx entre 1999 et 2004[2]. Ce n'est qu'après cette étude que Merck décide de retirer le Vioxx du marché, bien que de nombreuses études précédentes indiquaient des risques importants dus à l'utilisation de ce médicament[3].
- Étude VIGOR : Le Rofecoxib, testé en double aveugle contre le naproxène sur 2 000 patients sur neuf mois, un anti-inflammatoire classique, montre un doublement du nombre d'infarctus du myocarde. L'explication initiale était un effet "protecteur" du naproxene, qui n'a, en fait, jamais été démontré.
- Étude APPROVe : Le Rofecoxib est testé sur 2 600 patients, contre un placebo, sur 3 ans. L'étude a été interrompue de manière précoce devant le quasi doublement du nombre d'infarctus du myocarde dans le groupe traité.
Retrait
L'étude APPROVe a permis l'arrêt de la commercialisation de la molécule dans le monde entier.
En France, « seules quelques expertises ont été diligentées, à la demande du tribunal de grande instance de Paris, où une trentaine de demandes d'indemnisation étaient déposées en 2010 »[4]. Mais le retrait de la molécule a donné lieu à d'importantes controverses sur la fiabilité et la diffusion des informations sur le effets secondaires et l'efficacité des médicaments, mettant notamment en cause le laboratoire pharmaceutique[5] car des données montrant la majoration des risques cardiaques semblaient disponibles au moins depuis 2001 (trois ans avant le retrait de la molécule)[6].
Un rapport remis en écartait, pour tous les plaignants, toute imputation du Vioxx[4]. Néanmoins, il apparaît que, Bernard Rouveix[7], l'expert commis dans le dossier, pharmacologue de renom, avait omis de signaler qu'il avait précédemment travaillé pour l'avocat du laboratoire Merck[8],[4].
Justice
L’enquête fédérale aux États-Unis permet de démontrer rapidement que l'accroissement notable de la mortalité cardio-vasculaire sous Vioxx© avait été repérée par les expérimentateurs de Merck dès les premières études épidémiologiques, mais que sur ordre ces résultats ont été manipulés afin de ne pas nuire à la carrière prometteuse du produit.
En 2011 le groupe Merck Pharmaceuticals reconnait officiellement (selon un communiqué de presse du Département américain de la Justice) avoir eu connaissance de ces effets et avoir illégalement omis de préciser une partie des effets secondaires de l'anti-douleur (Vioxx)[9].
Des chercheurs et des responsables de l'entreprise ont de manière complice caché les preuves du fait que ce médicament avait, lors de ses essais cliniques, provoqué un nombre alarmant de crises cardiaques[10].
Les dirigeants, employés, chercheurs ou médecins de Merck n'ont pas été traduits en justice[11]. En échange, Merck a plaidé coupable et a payé une amende pour avoir violé la loi sur les produits alimentaires, cosmétiques et de santé dans le cadre de sa mise sur le marché du Vioxx[11]. Le directeur général de Merck (Raymond Gilmartin), responsable du dossier Vioxx, a néanmoins reçu un salaire de près de quarante millions de dollars lors de sa dernière année d’emploi dans le groupe[12], après quoi, Gilmartin n’a pas été poursuivi ni emprisonné mais accueilli à la Harvard Business School pour y donner des cours sur la responsabilité sociale des entreprises[13].
Le laboratoire Merck plaide coupable afin d’écourter le scandale et doit verser cinq milliards de dollars en 2005-2006 pour indemniser les victimes, puis verser, en 2011, 950 millions à l'Etat américain, pour « fausses déclarations sur la sécurité de son médicament aux fins d'augmenter ses ventes »[4].
Faux articles scientifiques et pressions sur les médecins
Plutôt que de divulguer ces résultats comme l'éthique médicale et la loi le demandaient, l'entreprise pharmaceutique Merck a engagé des auteurs fantômes qui ont écrit des articles trompeurs vantant l'innocuité et l'efficacité de Vioxx et qui ont ajouté leur nom comme coauteurs de l'article pour lui donner de la crédibilité dans le monde médical[10]. Merck et Elsevier, l’une des plus grandes maisons d’édition scientifiques au monde, ont édité une fausse revue médicale pour les publier, The Australasian Journal of Bone and Joint Medicine. « La présentation faisait penser à une revue à comité de lecture (peer-reviewed journal), mais n’était en fait qu’un outil publicitaire pour les médicaments de la société »[14],[15].
Le fabricant du Vioxx savait que les patients qui en prenaient multipliaient par six leur risque de faire une crise cardiaque, mais les représentants de Merck ont persuadé les médecins – via de fausses déclarations et des pots-de-vin – de prescrire le médicament aux patients[16]. Merck a pris le temps d'accumuler 11 milliards de dollars de ventes de Vioxx avant de le retirer lui-même du marché[17]. Les régulateurs américains ont estimé à au moins 60 000 personnes le nombre de morts dus à ce médicament[18].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Vioxx : Merck est condamné à verser 253 millions de dollars à une veuve, lemonde.fr, 20 août 2005
- (en) FDA Estimates Vioxx Caused 27,785 Deaths
- Claudine Proust, Vioxx : le réveil d'un scandale, leparisien.fr, .
- Retrait du Vioxx - Sénat
- (en) Ross JS, Madigan D, Hill KP¨et Als. Pooled analysis of Rofecoxib placebo-controlled clinical trial data, Arch Intern Med, 2009;169:1976-1985
- Bérénice Rocfort-Giovanni, Scandales pharmaceutiques : "Les autorités ne contrôlent plus rien", nouvelobs.com, 7 mars 2016
- https://www.lci.fr/france/le-scandale-du-vioxx-reveille-par-une-plainte-deposee-en-france-1253701.html
- (en) Communiqué de presse, U.S. Dep’t of Justice, U.S. Pharmaceutical Company Merck Sharp & Dohme to Pay Nearly One Billion Dollars Over Promotion of Vioxx® (Nov. 22, 2011) [hereinafter Merck Press Release], https://www.justice.gov/opa/pr/us-pharmaceutical- company-merck-sharp-dohme-pay-nearly-one-billion-dollars-over-promotion
- (en) Deanna Minasi (2017), Note, Confronting the Ghost: Legal Strategies to Oust Medical Ghostwriters, 86 FORDHAM L. REV. 299, 310 . Voir aussi Stephanie M. Greene, After Caronia : First Amendment Concerns in Off Label Promotion, 51 SAN DIEGO L. REV. 645 (2014) (discussing various concerns about off-label prescription drug use including undisclosed side effects)
- (en) Alexander Cockburn, When Half a Million Americans Died and Nobody Noticed, theweek.co.uk, 27 avril 2012
- Nesi Tom (2008) "Poison Pills : The untold story of the Vioxx durg scandal" 251.
- Raymond Gilmartin, CEOs Need a New Set of Beliefs, HARVARD BUS. REV. (Sep. 26, 2011), https://hbr.org/2011/09/ceos-need-a-new-set-of-beliefs.html (sharing thoughts on the path that CEOs should take, using his own experiences as the CEO of Merck to a professor of Harvard Business School).
- Merck et Elsevier ont édité une fausse revue médicale: outil marketing pour Fosamax et Vioxx. Ghost management révélé lors du procès Vioxx, pharmacritique.com
- (en) Merck published fake journal, the-scientist.com, 29 avril 2009
- (en) Carrie Johnson (2008), "Merck to Pay $650 Million in Medicaid Settlement", washington Post|mis en ligne le 08 février), http://www.washingtonpost.com/wp-dyn/content/article/2008/02/07/AR 2008020701336.html.
- (en) Linda A. Johnson (2008), Merck to Start Writing Vioxx Checks in August, CHARLOTTE OBSERVER (18 Juillet), https://www.charlotteobserver.com/news/business/article8993681.html.
- (en) Matthew Herper, David Graham ; dans "the Vioxx Verdict", dans FORBES (Aug. 19, 2005) ont estimé à 60,000 le nombre de morts (h_0819graham.html#2b3ed9175698) mais d'autres comme Alexander Cockburn, ont évoqué un demi-million d'américains morts sans qu'un lien ait été établi entre le médicament et la cause de leur mort, WEEK U.K. (Apr. 27, 2012) (http://www.theweek.co.uk/us/46535/when-half-million-americans-died-and-nobody-noticed.)
- Information de l'Agence France-Presse du 23 novembre 2009.
Voir aussi
Bibliographie
- (en) Bombardier C, Laine L, Reicin A, Shapiro D, Burgos-Vargas R, Davis B, et al. (2000). Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis. N Engl J Med 343 (21), 1520-8.
- (en) Bresalier RS, Sandler RS, Quan H, Bolognese JA, Oxenius B, Horgan K, et al. (2005). Cardiovascular events associated with rofecoxib in a colorectal adenoma chemoprevention trial. N Engl J Med 352 (11), 1092-102.
- (en) Grassley CE (15 Oct 2004), [PDF] Grassley questions Merck about communication with the FDA on Vioxx. Press Release.
- (en) Jüni P, Nartey L, Reichenbach S, Sterchi R, Dieppe PA, Egger M (2004), [PDF] Risk of cardiovascular events and rofecoxib: cumulative meta-analysis. The Lancet (published online)
- (en) Merck & Co., (5 Nov 2004). [PDF] Response to Article by Juni et al. Published in The Lancet on Nov. 5. Press Release.
- (en) Nussmeier NA, Whelton AA, Brown MT, Langford RM, Hoeft A, Parlow JL, et al. (2005). Complications of the COX-2 inhibitors parecoxib and valdecoxib after cardiac surgery. N Engl J Med 352 (11), 1081-91.
- (en) Solomon SD, McMurray JJ, Pfeffer MA, Wittes J, Fowler R, Finn P, et al. (2005). Cardiovascular risk associated with celecoxib in a clinical trial for colorectal adenoma prevention. N Engl J Med 352 (11), 1071-80.
- (en) Swan L, Merck Sharp & Dohme (Australia) Pty Ltd. (1 October 2004). Urgent Medicine Recall VIOXX® (rofecoxib) - Merck Announces Voluntary Worldwide Withdrawal of VIOXX.
Liens externes
- (en) [PDF] Merck's press release announcing the withdrawal - September 30, 2004
- (en) FDA Public Health Advisory on Vioxx
- (en) Vioxx Facts
- (en) David Michaels, « Doubt is Their Product », dans Scientific American, June 2004, p. 96-101
- Portail de la pharmacie
- Portail de la chimie