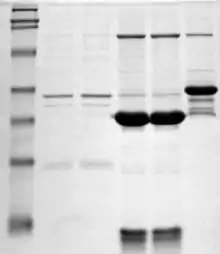
Électrophorèse sur gel de polyacrylamide en présence de dodécylsulfate de sodium
L'électrophorèse en gel de polyacrylamide contenant du laurylsulfate de sodium ou SDS-PAGE (sigle anglophone de sodium dodecyl sulfate polyacrylamide gel electrophoresis) est une technique de biochimie et de biologie moléculaire, qui est utilisée pour analyser les protéines et les séparer en fonction de la masse moléculaire de la chaîne polypeptidique. C'est une technique dénaturante qui dissocie les complexes protéiques non-covalents.
Principe
Formation d'un complexe protéine-SDS
En fonction de leur séquence en acides aminés, les protéines portent des charges de nombre et de nature variable : à pH neutre, les arginines et les lysines sont chargées positivement et les aspartates et les glutamates sont chargés négativement. Dans une électrophorèse en conditions natives, la force électrostatique à laquelle est soumise une protéine est donc variable en fonction de sa charge nette, qui dépend de sa composition et du pH dans le gel. Contrairement aux acides nucléiques dont la charge, portée par les groupements phosphate est proportionnelle à leur longueur, il n'y a pas de correlation entre la taille d'une protéine et sa charge nette. Ceci interdit l'analyse directe de la masse moléculaire des protéines par une électrophorèse directe.
Pour séparer les protéines en fonction de leur taille, on a donc recours à un artifice qui consiste à associer celles-ci à des molécules d'un détergent ionique chargé, le laurylsulfate de sodium (ou SDS, pour sodium dodecyl sulphate en anglais). Via sa longue chaîne hydrocarbonée, ce détergent forme des interactions hydrophobes avec la chaîne peptidique de la protéine et se fixe à raison d'environ une molécule de SDS pour deux acides aminés[1].
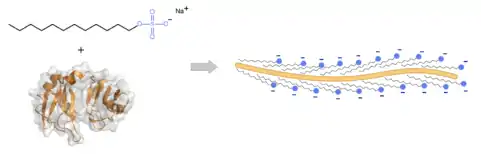
Le complexe protéine-détergent ainsi formé est fortement chargé, les nombreuses charges négatives des groupements sulfate du SDS l'emportant sur les quelques charges portées par la protéine. On obtient ainsi un complexe dont la charge totale est approximativement proportionnelle à la longueur de la chaîne peptidique et donc la force électrostatique s'exerçant lors de la migration en présence de SDS devient proportionnelle à la taille de la protéine.
En s'associant à la chaîne protéique, le SDS détruit aussi le repliement tridimensionnel et rompt également toutes les interactions non-covalentes avec d'autres protéines (dissociation des sous-unités de complexes...), c'est donc une technique dénaturante. On peut compléter ce traitement dénaturant par une réduction des ponts disulfure, ce qui permet de dissocier les complexes protéiques faisant intervenir ce type de liaisons. On utilise pour cela des agents réducteurs comme le 2-mercaptoéthanol ou le dithiothréitol, qui sont ajoutés au tampon d'échantillon avec le SDS.
Par ailleurs, la migration dans le gel peut enfin être affectée par des modifications post-traductionnelles covalentes des protéines: glycosylations ou phosphorylations par exemple, qui ne sont pas affectées par le traitement dénaturant.
Gel discontinu en deux parties

Les gels utilisés pour séparer les protéines par électrophorèse sont en général discontinus. Ils sont composés d'un gel dense, à pourcentage élevé en acrylamide, permettant la séparation suivant la taille, qui est précédé d'un gel de focalisation moins dense, permettant au préalable de concentrer l'échantillon, avant d'entrer dans la partie de séparation. Cette méthode permet d'avoir des bandes de protéines bien focalisées et donc bien résolues.
Les tampons utilisés pour ces deux gels, focalisation puis séparation, sont différents, avec des pH très spécifiques. Le gel de focalisation est à pH légèrement acide (pH 6,8), tandis que le gel de séparation est à pH basique (pH 8,8). Dans le tampon d'électrophorèse, le Tris-glycine, la glycine qui joue le rôle d'anion est faiblement chargée à pH 6,8 et migre donc très lentement, ce qui favorise la focalisation des protéines qui sont retenues dans le front de migration du tampon. La glycine porte en revanche une charge plus importante à pH 8,8, ce qui permet une migration rapide et la séparation ultérieure des protéines en fonction de la taille[2].
Le TEMED et le persulfate d’ammonium(le persulfate peut être remplacé par du sulfate, moins cher, moins polluant, et plus facile à éliminer après polymérisation) sont les catalyseurs de réaction, en fournissant des radicaux libres qui vont déclencher la polymérisation radicalaire. La grosseur des pores formés est fonction de la concentration d’acrylamide et du taux de bis-acrylamide. Le gel de séparation est assez concentré en acrylamide (8 à 15 % poids/volume), avec un pourcentage choisi en fonction de la taille des protéines à analyser. Plus la concentration est élevée, plus les pores seront petits et les molécules les mieux séparées seront celles de faible masse moléculaire. Le gel de focalisation est lui peu concentré (4 %, en général), son rôle étant seulement de permettre de concentrer l'échantillon en une bande focalisée avant la séparation.
Le détergent SDS est incorporé dans le tampon du gel et dans le tampon de migration, pour maintenir sa concentration constante et donc les conditions de dénaturation et de charge des protéines analysées. Ceci permet la migration des protéines dans la matrice à l’aide d’un courant électrique et la séparation des protéines s’effectue uniquement en fonction de leurs poids moléculaire (les protéines ayant un poids moléculaire plus faible migreront plus rapidement).
Révélation des protéines
Lorsque les protéines ont été séparées, leur visualisation peut être effectuée en les colorant directement (Bleu de Coomassie ou nitrate d’argent). Cette coloration permet de visualiser toutes les protéines dans l’échantillon dont la concentration dépasse la limite de détection de la coloration. Le gel coloré au bleu de Coomassie peut être ensuite décoloré par un mélange méthanol/acide acétique glacial/eau.
D'autres méthodes de révélation sont également possibles : par exemple par des anticorps spécifiques après transfert sur une membrane (western blot) ou par autoradiographie lorsque les protéines sont marquées par un radio-isotope.
Articles connexes
Notes et références
- J. A. Reynolds et C. Tanford, « Binding of dodecyl sulfate to proteins at high binding ratios. Possible implications for the state of proteins in biological membranes », Proceedings of the National Academy of Sciences of the United States of America, vol. 66, , p. 1002–1007 (ISSN 0027-8424, lire en ligne, consulté le )
- U. K. Laemmli, « Cleavage of structural proteins during the assembly of the head of bacteriophage T4 », Nature, vol. 227, , p. 680–685 (ISSN 0028-0836, lire en ligne, consulté le )
- Portail de la biologie cellulaire et moléculaire