Sacculina carcini
La sacculine (Sacculina carcini Thompson, 1836) est un crustacé parasite du crabe vert Carcinus maenas ainsi que de plusieurs autres crabes de la famille des Portunidae (dont Liocarcinus holsatus) et des Pirimelidae[1]. C'est un des parasites marins des eaux européennes les plus connus. L’espèce appartient aux Rhizocéphales, tous parasites de décapodes marins, un super-ordre de l’infra-classe des Cirripèdes.

Les Rhizocéphales (de « rhizo » = racine et « cephale » = tête) ne possèdent à l’état adulte ni appendices ni traces de segmentation ni organes internes à l’exception des gonades et du système nerveux[2]. Leur appartenance à la classe des Crustacés et plus précisément aux Cirripèdes n’est révélée que par la morphologie de leurs larves nauplius, munies notamment de cornes frontales et par la présence d’une larve cypris.
Description
La sacculine apparaît comme une sorte de sac (d’où son nom), légèrement aplati antéropostérieurement et au contour vaguement pentagonal, inséré dans l’espace entre l’abdomen (la « languette ») et le céphalothorax (« tête ») du crabe. Initialement jaune ou orangé sa couleur évolue vers une teinte plus sombre, brunâtre ou brun noir chez les formes âgées [3], sa taille (dimension transversale) atteint 26 mm[1]. Ce sac est relié à la face ventrale de l’abdomen du crabe par un court pédoncule (souvent inséré à cheval sur le deuxième et troisième segment abdominal) à partir duquel tout un réseau de filaments jaunes, comparables à des racines divergent et se répandent dans tout le corps de l’animal, y compris les appendices, à l’exception des branchies et du cœur[4]. Ces filaments ont une fonction absorbante : ils prélèvent les éléments nutritifs dans le corps du crabe et les véhiculent jusqu’à la masse externe du parasite et également sécrétrice[5].
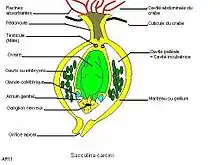
Le sac externe, dont la paroi constitue le manteau, est muni, à l’opposé du pédoncule, d’un orifice, muni d’un sphincter, qui débouche dans une vaste cavité, la cavité palléale ou cavité incubatrice, au milieu de laquelle se trouve, inséré comme le battant d’une cloche, une masse allongée qui renferme l’ovaire (deux organes soudés ?), disposant de deux ouvertures, précédées d’un atrium génital, donnant sur la cavité palléale. Des glandes dites collétériques élaborent une sécrétion, déversée dans l’atrium, qui enveloppe les œufs dans la cavité incubatrice[4].
À la base du battant sont insérés deux éléments mâles, les testicules.
Muni à la fois d’un ovaire et de testicules, le parasite paraît être de nature hermaphrodite. Ceci n’est cependant pas exactement le cas, car ces organes proviennent de trois individus différents. Le plus gros d’entre eux est formé du sac et ses « racines » et possède l’ovaire. Les deux autres, pratiquement réduits à l’état de testicules, proviennent de deux larves différentes et sont comme greffés sur l’individu femelle (ou parasites de celui-ci, c’est-à-dire hyperparasites du crabe). La sacculine constitue donc un « ménage à trois », expression aussi facile à mémoriser que le terme de « cryptogonochorisme » qui est également utilisé, à juste titre, pour désigner cette association[6]. L’espace entre le battant de cloche et le manteau est occupé par des œufs en cours de développement ou des larves (nauplius) sur le point d’éclore et d’être libérées dans l’eau. Le ganglion nerveux occupe une position proche de l’extrémité du battant.
Il arrive que l'on trouve deux sacculines sur le même crabe (2,8 % des cas au Royaume uni) et plus exceptionnellement encore trois[7].
Développement
Le cycle vital de la sacculine est relativement complexe, il a fait l’objet des recherches (1884) de Yves Delage[8].
Développement larvaire
Les larves nauplius possèdent des cornes frontales, comme l’ensemble des cirripèdes mais sont dépourvues de tube digestif. Elles ne s’alimentent donc pas et utilisent leurs propres réserves (elles sont dites lécithotrophes) pour se déplacer et se transformer. La phase nauplius comporte quatre stades. Elle est de courte durée : 4 à 8 jours en tout[9],[10]. Le dernier nauplius mue en donnant une larve cypris, également dépourvue de tube digestif. La sacculine produit, éventuellement dans la même ponte et en proportion variable, des larves mâles et des larves femelles. La différence entre les deux sexes apparaît dès le stade nauplius[11] et plus nettement au stade cypris, les mâles sont de taille statistiquement plus grande que les femelles et possèdent deux soies sensorielles, dont une de grande taille, sur le quatrième article de l’antennule alors que les femelles n’en ont qu’une seule, petite[6].
Devenir des cypris femelles
La larve cypris femelle (longueur 240-260 µm[3] nageant dans le plancton vient se fixer, grâce à ses antennules, à la base d’une soie (exclusivement les soies sensorielles, plumeuses[12]) du corps ou des appendices d’un jeune crabe d’une largeur de carapace allant de 2–3 mm jusqu’à 15, voire 25 mm[3]. La larve fixée subit alors une métamorphose spectaculaire[8],[13]. La partie postérieure du corps (thorax = péréion) de l’animal s’en détache et est éliminée. Les tissus de la région antérieure s’enveloppent dans une ampoule chitineuse ovoïde, munie à son extrémité d’un stylet creux. Cette formation est appelée kentrogone (de « kentro » = piquant), elle permet d’injecter littéralement les tissus qu’elle contient dans le corps du crabe. Une période de 5 jours sépare le moment où la cypris se fixe sur le crabe et celui de l’inoculation[12]
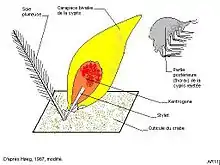
Cette masse de tissus (l’« interna ») migre dans le crabe, s’attache à la face ventrale de l’intestin puis se ramifie et sa partie principale finit par atteindre la face ventrale de l’abdomen où elle constitue un nodule, de 2 mm de diamètre environ, appelé « nucleus »[4]. Ce nodule perfore le tégument du crabe et vient faire saillie à l’extérieur, on l’appelle alors l’ « externa » dont le diamètre va de 2 à 5 mm[3]. C’est la forme femelle vierge du parasite qui ne peut poursuivre sa croissance tant que les mâles ne s’y sont pas implantés. La formation de l’ « externa » s’observe chez les crabes ayant accompli leur mue de puberté et atteint une largeur céphalothoracique d’environ 30 mm. Ils sont alors âgés de 2 ans à 2 ans 3/4. L’évolution du parasite interne dure donc au moins 33 mois. Éventuellement des « externa » émergent chez des crabes beaucoup plus âgés, jusqu’à 7 ans[3]. Ces données concernent le Danemark, les durées ont des valeurs plus faibles dans des eaux plus méridionales et plus chaudes. On cite des durées de 9 mois (Day) au Royaume uni et 21 mois à Roscoff (Delage)[7]. En Méditerranée la sacculine interne émigre pendant un mois environ, elle devient externe à l’âge de deux mois (dès que l’hôte dépasse 12 mm de longueur de carapace) et pond deux mois et demi plus tard[12].
Devenir des cypris mâles
La larve cypris mâle (longueur 270-300 µm[3]) recherche une femelle à l’état d’ « externa » vierge et vient se positionner près de l’orifice de celle-ci sous un lambeau de cuticule qui le recouvre généralement. Dans des conditions expérimentales on peut en observer jusqu’à 20 dans cette situation[9], ce qui illustre, si besoin est, l’efficacité du système de détection des cypris mâles.
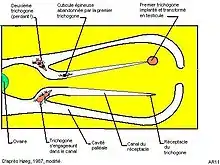
Le mâle subit alors une métamorphose rapide : en moins de 20 minutes sa partie postérieure et des éléments de la région antérieure se désintègrent alors que le restant de la partie antérieure se transforme en un petit organisme à cuticule épineuse appelé trichogone[13] (de "tricho" = poil) qui s’échappe en quelques secondes par une fente du deuxième article d’une des antennules et pénètre dans la cavité palléale de la femelle puis dans le canal du réceptacle où il perd sa cuticule épineuse, pour aller s’implanter dans le réceptacle-même de la femelle et évoluer en testicule. Le trajet complet dure une dizaine d’heures et 5 jours après l’implantation la spermatogenèse démarre[13]
Fonctionnement de l'« externa »
Les sacculines deviennent externes principalement à la fin du printemps et au début de l’été. Si l’ « externa » reçoit des implants mâles (2 ou éventuellement un seul) elle entre en croissance et commence à se reproduire au bout de quelques semaines, surtout en juillet août et plusieurs pontes peuvent se suivre. Le rythme de ponte va en décroissant jusqu’en décembre et pratiquement il s’interrompt durant l’hiver pour reprendre en avril-mai. Éventuellement durant l’hiver la cavité palléale contient du sable. Le nombre d’œufs par portée dépasse 100 000 et peut atteindre presque 300 000 pour une femelle de grande taille[3]
La durée de vie de l’ « externa » est d’environ un an.
Compte tenu du fait que les « externa » vierges doivent être implantées en mâles pour se reproduire il est impératif qu’il y ait des cypris mâles dans le plancton lorsque ces « externa » vierges apparaissent. Ceci est rendu possible d’une part par le fait qu’il existe une certaine période de recouvrement entre les deux générations consécutives de femelles et d’autre part par le fait que les pontes contiennent une majorité de cypris mâles (éventuellement 100 %) de septembre à juin alors que les pontes de début juin à fin septembre contiennent une majorité de femelles (éventuellement 100 %)[10]. La proportion des mâles et des femelles n’est pas commandée par les facteurs externes elle pourrait être déterminée par la condition de l’hôte, c’est-à-dire le crabe[10].
Sacculina carcini est susceptible de parasiter plusieurs espèces de crabes et il est possible que son cycle vital présente des variations en fonction de ses divers hôtes[7] et s'écarte donc de celui indiqué ici et concernant Carcinus maenas.
Effets du parasite sur le crabe
Les sacculines se rencontrent principalement sur des crabes mâles qui représentent les 2/3, voire les 3/4 des animaux infectés[3].
Les effets du parasite durant la phase interne ont été décrits à partir d'infestations expérimentales[14]. Le système radiculaire de la sacculine colonise d'abord la masse ganglionnaire ventrale de l'hôte, provoquant ainsi des lésions du système nerveux central du crabe. Puis d'autres modifications physiologiques interviennent, probablement sous l'influence de sécrétions dont la nature est encore inconnue[15].
Une fois l’« externa » en place le crabe ne mue plus, sa croissance somatique est donc bloquée et il n’y a plus d’activité sexuelle ni chez le mâle ni chez la femelle chez laquelle la sacculine occupe la place normale de la ponte.
Le parasite exerce évidemment une action spoliatrice sur son hôte en détournant à son profit les nutriments qui normalement permettent sa croissance somatique (le poids sec de tissus des animaux infectés est de 12 % inférieur à celui des animaux sains[16]) et la reproduction.
Chez les crabes mâles la présence de la sacculine entraîne une certaine féminisation de l’hôte dont l’abdomen, normalement triangulaire et étroit s’élargit sensiblement et la séparation entre les métamères 3-4-5, discrète à la suite de leur fusion, devient plus nette. Des pléopodes supplémentaires peuvent apparaître. Ces perturbations avaient d'abord été attribuées à une diminution de l’activité de la glande androgène responsable de la différenciation des caractères sexuels primaires et secondaires du mâle.Mais cette hypothèse a été abandonnée car il n'y a pas de corrélation entre l'invasion de la glande androgène et le degré de féminisation des crabes mâles et, surtout, cette hypothèse ne peut expliquer la castration parasitaire des crabes femelles. La castration parasitaire serait due d'une part à une perturbation du contrôle neuro-endocrine du fonctionnement gonadique par destruction des centres nerveux, et d'autre part, à l'émission par les racines de la sacculine d'une substance toxique, la sacculininine[17],[11].
De l’absence de mues chez les crabes parasités, aggravé probablement par le fait qu’ils s’enterrent moins volontiers dans les sédiments que les animaux sains, il résulte que les premiers portent des épibiontes (balanes, tubes d’annélides serpulidés) fixés sur leur cuticule plus souvent (75 % des cas contre 29 %) et en plus grand nombre que les seconds[16].
Après la chute de l’ « externa » le crabe est susceptible de muer de nouveau. Dans quelques rares cas une nouvelle «externa » peut être régénérée à partir des tissus qui subsistent dans l’abdomen de l’hôte[3].
Répartition
 Sacculina carcini, parasite d'une femelle de crabe vert, Carcinus maenas
Sacculina carcini, parasite d'une femelle de crabe vert, Carcinus maenas
Références
- Hayward, P.J & Ryland, J.S. 1995. Hanbook of the marine fauna of north-west Europe. Oxford University Press 800 p.
- Schram F.R. 1986. Crustacea. Oxford University Press. 606 p.
- Jørgen Lützen, « Growth, reproduction and life span in Sacculina carcini Thompson (Cirripedia : Rhizocephala) in the Isefjord, Denmark », Sarsia, vol. 69, , p. 91-106
- Calman, W.T. 1909. Crustacea. In Lankester, Sir R. A treatise on zoology. A. & C. Black éd. London. 346p.
- Claudio Rubiliani & Geneviève G. Payen, « Modalités de la Destruction des Régions Neurosécrétrices des Crabes Carcinus maenas (L.) et C. mediterraneus Czerniavsky Infestés par la Sacculine », General and Comparative Endocrinology, vol. 38, no 2, , p. 215-228 (DOI 10.1016/0016-6480(79)90209-0)
- (en) Hoeg, J.T. 1987 b. The relation between cypris ultrastructure and metamorphosis in male and female Sacculina carcini (Crustacea, Cirripedia). Zoomorphology, 107: 299-311.
- Foxon, G.E.H. Notes on the life history of Sacculina carcini Thompson.Sabella.mba.ac.uk.
- Delage, Y.1884. Évolution de la sacculine (Sacculina carcini Thomps.) Crustacé endoparasite de l’ordre nouveau des Kentrogonides. Arch. Zool. exp. gén. 2 :417-736
- Hoeg, J.H. 1984. Size and settling behaviour in male and female cypris larvae of the parasitic barnacle Sacculina carcini Thompson(Crustacea: Cirripedia:Rhizocepahala). J. Exp. Mar. Biol. Ecol. 76 : 145-156.
- Walker, G. 1988. Observations on the larval development of Sacculina carcini (Crustacea : Cirripedia : Rhizocephala). J. Mar. Biol. Ass. U.K. 68 : 377-390
- C.Rubilian, Les Relations hôte-Parasite chez les Crustacés : développement et modalités d'action des Rhizocéphales Sacculinidae sur la Reproduction des Crabes, Thèse de Doctorat d'Etat, Université P. & M. Curie, 27/04/1984.
- Veillet, A. 1945. Recherches sur le parasitisme des Crabes et des Galathées par les Rhizocéphales et les Epicarides. Ann. Inst. Océan. 22 : 193-341
- Hoeg, J.T. 1987 a. Male cypris metamorphosis and new male larval form, the trichogon, in the parasitic barnacle Sacculina carcini (Crustacea : Cirripedia : Rhizocephala). Phil. Trans. R. Soc. Lond. B 317 : 47-63.
- C. Rubiliani, Y. Turquier & G.G. Payen, « Recherche sur l'ontogenèse des Rhizocéphales : les stades précoces de la phase endoparasitaire chez Sacculina carcini Thompson », Cahiers de Biologie Marine, vol. 23, no 3, , p. 287-297
- (en) Claudio Rubiliani, « Action of a rhizocephalan on the genital activity of host male crabs: characterization of a parasitic secretion inhibiting spermatogenesi », International Journal of Invertebrate Reproduction, vol. 6, no 3, , p. 137-147 (DOI 10.1080/01651269.1983.10510036)
- Mouritzen, K.N. & Jensen, T. 2006. The effect of Sacculina carcini infections on the fouling, burying behaviour and condition of the shore crab, Carcinus maenas1. Marine Biology Research, 2:270-275. Abstract
- Pierre Cassier, René Lafont, Michel Descamps, Maurice Porchet, Daniel Soyez, La reproduction des invertébrés, Masson, .
Liens externes
- (en) Référence Animal Diversity Web : Sacculina carcini (consulté le )
- (en) Référence BioLib : Sacculina carcini Thompson, 1836 (consulté le )
- (fr) Référence Catalogue of Life : Sacculina carcini Thompson, 1836 (consulté le )
- (fr) Référence DORIS : espèce Sacculina carcini (consulté le )
- (fr+en) Référence ITIS : Sacculina carcini Thompson, 1836 (consulté le )
- (en) Référence NCBI : Sacculina carcini (taxons inclus) (consulté le )
- (en) Référence uBio : Sacculina carcini Thompson, 1836 (consulté le )
- (en) Référence World Register of Marine Species : espèce Sacculina carcini Thompson, 1836 (consulté le )
- Portail de la carcinologie et des crustacés
- Portail du monde maritime