Salicylaldoxime
Le salicylaldoxime est un composé organique de formule C6H4CH=NOH-2-OH. C'est l'oxime du salicylaldéhyde. C'est un solide cristallin chélateur qui est parfois utilisé pour l'analyse d'échantillons contenant des ions de métal de transition ions, avec lesquels il forme des complexes avec des couleurs brillantes[3].
| Salicylaldoxime | |
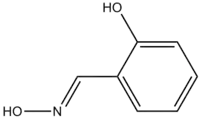
| |
| Identification | |
|---|---|
| Nom UICPA | 6-[(hydroxyamino)méthylidène]cyclohexa-2,4-dièn-1-one |
| Synonymes |
Saldox |
| No CAS | |
| No ECHA | 100.002.140 |
| No CE | 202-353-8 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C7H7NO2 [Isomères] |
| Masse molaire[1] | 137,136 ± 0,006 9 g/mol C 61,31 %, H 5,14 %, N 10,21 %, O 23,33 %, |
| Propriétés physiques | |
| T° fusion | 57 °C[2] |
| Écotoxicologie | |
| LogP | 1,390 [2] |
| Unités du SI et CNTP, sauf indication contraire. | |
À l'époque où les métaux ont été analysés par spectrophotométrie, beaucoup de ligands chélateurs formant sélectivement des complexes colorés avec certains métaux ont été développés. Cette méthode a été éclipsée par l'introduction de la spectrométrie par torche à plasma. Le salicylaldoxime peut être utilisé pour faire précipiter de façon sélective des ions métalliques pour détermination gravimétrique. Il forme par exemple des précipités vert-jaune avec le cuivre à pH 2,6 en présence d'acide acétique. Sous ces conditions, c'est le seul métal qui précipite; à pH 3.3, le nickel précipite également. Les ions fer(III) interfèrent cependant[4].
Adsorbé ou chimiquement lié à un support solide tel qu'un gel de silice, il peut être utilisé pour préconcentrer ou extraire des métaux d'une solution diluée, comme de l'eau de mer[5]. Il a été utilisé comme ionophore dans les électrodes sélectives d'ions, avec une bonne réponse envers Pb2+ et Ni2+[6].
Le salicylaldoxime a aussi été utilisé pour sonder les canaux ioniques dans les tissus musculaires[7] et comme sonde du photosystème I[8].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Salicylaldoxime », sur ChemIDplus, consulté le 19 mars 2011
- (en) P Sedwick, « The Separation Of Metals From Treated Deep-Sea Ferromanganese Nodules By Adsorptive Bubble Techniques Using Salicylaldoxime And Sodium Diethyldithiocarbamate As Organic Precipitating Reagents », Separation Science and Technology, vol. 19, nos 2-3, , p. 183–190 (DOI 10.1080/01496398408060654)
- (en) SH Simonsen, « Spectrophotometric Determination Of Copper With Salicylaldoxime - Application To Analysis Of Aluminum Alloys », Analytical Chemistry, vol. 27, no 8, , p. 1336–1339 (DOI 10.1021/ac60104a039)
- (en) AR Sarkar, « Sorption Recovery of Metal Ions Using Silica Gel Modified with Salicylaldoxime », Talanta, vol. 43, no 11, , p. 1857–1862 (DOI 10.1016/0039-9140(96)01953-4)
- (en) EK Quagraine, « Studies Of Spectrophotometric Reagents In Some Transition-Metal And Lead Ion-Selective Electrodes », Analyst, vol. 117, no 12, , p. 1899–1903 (DOI 10.1039/an9921701899)
- (en) H Chunlei, « Multiple Effects Of Salicylaldoxime On Rat Cardiac Action-Potentials », Pharmacology & Toxicology, vol. 77, no 6, , p. 386–390 (PMID 8835364, DOI 10.1111/j.1600-0773.1995.tb01047.x)
- (en) S Katoh, « Inhibitory Effect Of Salicylaldoxime On Chloroplast Photooxidation-Reduction Reactions », Biochemical and Biophysical Research Communications, vol. 24, no 6, , p. 903 (PMID 5970525, DOI 10.1016/0006-291X(66)90335-4)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Salicylaldoxime » (voir la liste des auteurs).
- Portail de la chimie