Scanner spectral X
Le scanner spectral X aussi connu sous l’acronyme SCT (de l'anglais : Spectral Computed Tomography), est une modalité d’imagerie médicale récente qui allie le principe de la tomographie par rayon X (CT) et l’utilisation de plusieurs niveaux d’énergie afin de pouvoir identifier la composition d’une substance d'intérêt. Le scanner spectral permet de réaliser ce qu'on appelle une imagerie spectrale ou encore dite au K-edge des éléments (matériaux). Il existe de nombreuses technologies permettant de faire du scanner spectral présentant chacune leurs lots d'avantages et d'inconvénients.
Principe physique
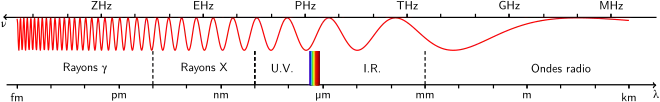
Le principe du scanner se base sur l'exploitation de l'absorption d'un faisceau de photons à forte énergie (dans la gamme des rayons X).
Le comportement de ce faisceau suit une loi de Beer-Lambert: Plus précisément, le scanner est une modalité qui réside sur l'exploitation de la transmission des rayons X au travers d'un matériau. Lors de ce passage, ceux-ci peuvent subir différents effets tels que l'effet Compton, photoélectrique et la diffusion Rayleigh.
Ces différents effets sont regroupés dans le coefficient d'absorption µ de la loi de Beer-Lambert correspondant à l'ensemble des absorptions et diffusions subies par le rayon X lors de son interaction avec le matériau.
- : est l'intensité de la lumière incidente.
- : est l'intensité de la lumière sortante.
- : est le coefficient d'atténuation du ième matériau (en m-1 ou en cm-1).
- : est la longueur du trajet optique dans le ième matériau (en mètres ou en centimètres).
.png.webp)
Le système d'acquisition détecte alors le rayon sortant et en déduit par le calcul donnée ci-dessous une cartographie du coefficient d’absorption (appelée projection en 2D de l'objet).
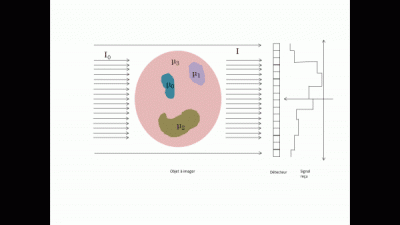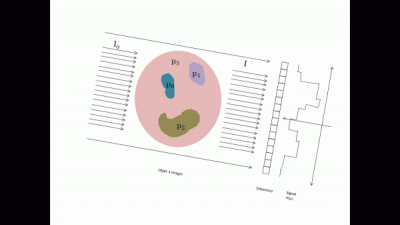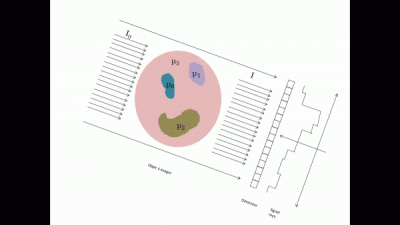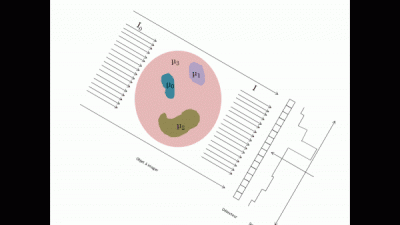
En répétant différentes projections à différents angles tout autour de l'objet (typiquement une projection tous les degrés), on a les informations nécessaires pour reconstruire l'objet en 3D. Cette reconstruction s'effectue à l'aide d'algorithme de reconstruction de type FDK (Feldkamp, David et Klauss)[1].
En réalité le coefficient d'atténuation du matériau dépend de l'énergie du photons qui le traverse :
où λ est la longueur d'onde de la radiation incidente. Étant la partie imaginaire de l'indice de réfraction complexe, k est sans dimension. En utilisant la relation de Planck Einstein on obtient alors une relation direct entre le coefficient d'absorption et l'énergie des photons qui traverse la matière:
- est le coefficient d'atténuation (en m−1 ou en cm−1).
- est le coefficient d'extinction linéique, il exprime l'atténuation de l'énergie du rayonnement électromagnétique à travers le milieu.
- est l'énergie du photon (en joules) ;
- est la constante de Planck dont une valeur approchée est : h ≈ 6,626 069 57 × 10−34 J s.
C'est cette caractéristique qu'exploite le scanner spectral. En faisant l'acquisition d'images du même objet à différentes énergies, le scanner spectral est non seulement capable de reconstituer la structure anatomique de l'objet imagé (scanner classique) mais également de retrouver la composition d'un élément contenu dans l'objet (scanner spectral). Chaque matériau présente une réponse spectrale (variation du coefficient absorption) qui lui est propre en fonction de l'énergie. C'est ainsi que deux matériaux avec un coefficient d'absorption linéique proche pour une certaine énergie, peuvent être complètement différent à une autre énergie.
Avantages
Utilisation du spectre des tubes X
Un inconvénient pour le scanner conventionnel qui devient un avantage pour le scanner spectral est le spectre relativement étalé du tube X. En tomodensitométrie conventionnelle, la solution que l'on met en œuvre pour filtrer la partie non utile du spectre réduit le rendement du système de production de rayons X. Mais en scanner spectral (pour certaines solutions uniquement), on va utiliser une plus grande partie du spectre car nous avons besoin d'au moins deux niveaux d'énergie pour réaliser le cliché.

Identification de la composition
Contrairement au scanner conventionnel pour lequel une image est acquise autour d'un niveau d'énergie, le scanner spectral utilise plusieurs niveaux d'énergies afin de déterminer plus finement les différents constituants en se basant sur la dépendance du coefficient d'absorption en fonction de l'énergie.
Inconvénients
Utilisation de produits de contraste
Le scanner spectral comme le scanner X est un examen quasiment anodin. Le produit de contraste dit aussi agent de contraste le plus couramment utilisé est de l'iode chez l'homme. Cependant, il existe quelques cas de contre-indication chez certains patients. Ci-dessous une liste non exhaustive des cas de contre-indication :
- patients souffrant d'insuffisance rénale ;
- diabétiques utilisant des médicaments comme la metformine ;
- patients ayant une allergie à un ou plusieurs produits de contrastes ;
- les femmes enceintes ou allaitant ;
- patients non-coopératifs ou anxieux : jeunes enfants, claustrophobes, etc.
Irradiation
Comme tout type d’imagerie médicale utilisant les rayons X, il y a le phénomène d’irradiation du patient qui est incontournable. Il faut limiter la dose d’irradiation (en sievert Sv) que le patient reçoit. Pour cela, le radiophysicien se chargeant de faire passer l’examen doit configurer l’appareil (scanner X, scanner spectral, radio X…) pour limiter la dose envoyée. Un tube à rayon X n’émettant jamais à un seul niveau d’énergie (en électron-volt), le patient reçoit un spectre plus ou moins étalé dont certains niveaux énergétiques (en particulier les niveaux de très basses énergies) vont être entièrement absorbés par le corps. Certains de ces niveaux peuvent cependant être inutiles pour l’examen car non détectés au niveau du détecteur. Dans ce cas la, on utilise un filtre pour éviter cette exposition aux très basses énergies. Le plus grand danger de l’irradiation est celui de développer un cancer. Lors du calcul de la dose, il faut donc faire un compromis entre le contraste de l’image (plus la dose est élevée, plus l’image sera nette et contrastée) et le risque d’irradiation (plus la dose est élevée, plus le risque est élevé).
Les risques d’irradiations ne sont pas uniquement réservés au patient. En effet, le Manipulateur d'Electro-radiologie également appelé Technicien en Imagerie Médicale pratiquant l'examen est lui aussi exposé à ces rayons X., ainsi que l'ensemble du personnel présent dans la salle d'examen. Il y a donc un suivi dosimétrique (port obligatoire d'un dosimètre) du personnel par une PCR (personne compétente en radioprotection), et l'utilisation d'équipements de protection collectifs (vitre plombée) ou individuels (tabliers plombés) dans la salle d’examen. La salle d'examen est une enceinte contenant une source d'émission de rayons X où tous les murs sont plombés. L'ensemble salle d'examen et source d'émission sont vérifiés tous les ans par des organismes agrées. L'habilitation à manipuler des sources à émission de rayonnements ionisants sur le corps humain est de la responsabilité du médecin, et du manipulateur qui agit sous prescription. Toutes les personnes présentes dans l'enceinte doivent posséder une aptitude médicale.
Il y a également des risques de brûlure (radiome) dues aux niveaux d’énergie utilisés et au temps d'exposition.
Technologies
Il existe un grand nombre de technologies permettant de réaliser un scanner spectral. Elles sont pour la plupart encore en cours de développement ou bien très récemment mises en essais pré-cliniques dans les centres d'imagerie médicale. Les technologies peuvent être classées en deux grandes familles de solutions : les solutions mettant en œuvre des sources spécifiques et les solutions jouant sur les types de détecteurs.
Stratégies basées sur la source
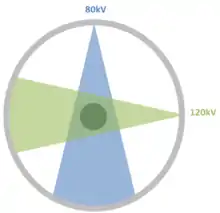
L’utilisation de sources à double énergie permet de fournir des images de meilleure résolution qu’avec une source à rayons X ne fonctionnant que sur un seul niveau d’énergie. Le DSCT[2] est particulièrement adapté aux acquisitions d’images cardiaques qui demandent une grande vitesse de prises de vues. Chaque matériau dispose de sa propre courbe d’absorption. Par différence entre les deux acquisitions, il est possible de déterminer beaucoup plus précisément quel type de matériau a été traversé. L'information en niveau de gris ajoutée par la deuxième source permet de réaliser des images couleurs.
Dual Source
L’utilisation de deux sources indépendantes, généralement déphasées spatialement de 90°, est une première méthode employée en DSCT. L’utilisation de deux sources à rayons X ne veut pas dire que la dose de rayons délivrés au patient sera plus importante. En effet, cette technique permet de réduire par deux le temps d’exposition du patient. La dose reçue est similaire voire inférieure à un scanner CT classique. Les progrès en termes d’algorithme de reconstruction intégré sur les scanners CT à deux énergies participent grandement dans la réduction du temps d’exposition.

Kv-switching
Le kV switching[3] est une méthode d’acquisition d’images issue du dual energy CT. Deux stratégies d’acquisition appelées fast et low kV switching peuvent être utilisées.
Dans le cadre du low kV switching, deux scanners CT classiques sont réalisés l’un à la suite de l’autre. Pour avoir des images nettes, il faut que le patient et ses organes observés soient restés le plus immobiles possible. Différentes techniques d’acquisition sont utilisées :
- acquisition partielle du patient (180°) dans une énergie puis acquisition partielle à 180° dans un autre niveau d’énergie ;
- deux acquisitions spirales successives à deux niveaux d’énergie ;
Le fast kV switching repose sur la transition des niveaux d’énergie lors de l’acquisition CT. C’est une technique moins sensible aux mouvements du patient.
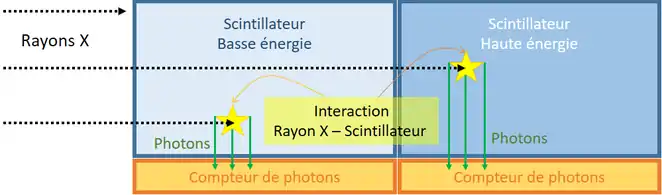
Dual layer detector
Ce type de détecteur comprend deux couches de cristaux scintillateurs. Il est ainsi possible de séparer des rayons de niveau d’énergie différents. Les rayons X ayant une énergie plus faible sont piégés dans la première couche du scintillateur alors que les rayons de plus forte énergie continuent leur route. Associé à chaque couche se trouve un réseau de photodiodes permettant l’acquisition du signal lumineux émis dans le scintillateur.
K-edge filtering
Le K-edge[4] matérialise l'énergie de liaison des électrons sur la couche K (interne) de l'atome. Lorsqu'un photon incident vient réaliser un effet photoélectrique sur un atome, si le photon est d'énergie supérieure à l'énergie de liaison de l'électron sur l'atome alors l'électron est éjecté et se traduit par une brusque saut en absorption qui a lieu à une énergie caractéristique pour chaque atome considéré. (ex K-edge de l'iode a lieu à 33.3 keV).
Le principe général du K-edge consiste à détecter les variations d'énergie au niveau du spectre reçu. Ces variations du taux d'absorption sont différentes selon les atomes étudiés. Une étude du spectre détecté par rapport au spectre initial de la source permet de déterminer la présence d'un élément dans l'objet imagé situé entre la source et le détecteur.
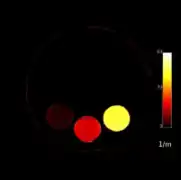
L'exemple présenté ci-dessous montre une coupe coronale d'un fantôme contenant différents inserts remplis d’une solution d’iomeron 350 diluée dans les concentrations 20, 30 et 40 mg/mL d’iode, d’une solution de nitrate d’argent dans les concentrations 11, 22, 43 mg/mL d’argent et deux autres contenant du sulfate de cuivre, puis de l’eau[5].
L'image de gauche représente une image obtenue en scanner classique englobant tout le spectre de rayons X. L'image du milieu est l'image obtenue au K-edge de L'iode et celle de gauche au K-edge de l'argent (25.5 keV).
La différence d'intensité de couleurs dans ces deux dernières est fonction de la concentration en agent de contraste (iode ou argent).
Essais et développements en cours
Détecteurs utilisés
Le détecteur Medipix2 est un détecteur développé dans le cadre d'un collaboration internationale au CERN. Il fait partie de la famille des détecteurs à comptage de photons. Il est spécialement conçu pour réaliser de l'imagerie médicale. Depuis 1997, plusieurs générations de ce détecteur ont été développées : Medipix1, Medipix2, Medipix3 et Timepix qui constitue la dernière génération de ce détecteur.
Le développement des détecteurs à pixels hybrides XPAD a commencé au CPPM/IN2P3 (Centre de physique des particules de Marseille). Le développement et la commercialisation de caméras utilisant ces détecteurs sont aujourd'hui assurés par la start-up imXPAD.
D'autres détecteurs sont disponibles sur le marché :
- PILATUS commercialisé par la société Dectris
- EIGER développé par le groupe PSI
- PIXIE du groupe INFN/Pisa
 Medipix2/.
Medipix2/. Caméra XPAD3, imXPAD[5].
Caméra XPAD3, imXPAD[5].
Scanners spectraux

Quelques exemples de scanners spectraux en développement ou en essais cliniques :
- Philips IQon Spectral CT ;
- Scanner spectral au CERMEP, Lyon, France ;
- micro-CT PIXSCAN II.
Applications
Densitométrie osseuse
Dans le cadre de certaines maladies comme l'ostéoporose, il peut être nécessaire de pouvoir mesurer la densité minérale osseuse (DMO) qui caractérise la quantité de calcium dans un volume donné de matière osseuse. Ainsi il devient possible d'évaluer le risque de fracture d'un os, mais aussi d'affirmer ou infirmer le bon fonctionnement d'un traitement médicamenteux qui pourrait venir stimuler la maturation des ostéoclastes par exemple pour les personnes atteintes d'ostéoporose. Dans ce cadre, le scanner spectral est à l'étude[réf. nécessaire].
Notes et références
- (en) Feldkamp L. A. et Coll, « Practical cone-beam algorithm », article, , J. Opt.Soc. Am. A, 1(6):612–619 (lire en ligne)
- (en) DSCT.com, Dual Source CT community, http://www.dsct.com
- (en) "Techniques to Acquire Spectral CT Data", SPIE, https://spie.org/samples/PM226.pdf
- (en) Michael Clark, Spectral CT: Image processing and revised Hounsfield units, University of Canterbury, 2009.
- Kronland-Martinet 2015.
- (en)"Dual Energy Spectral CT Imaging for Colorectal Cancer Grading: A Preliminary Study", Hong-xia Gong, Ke-bei Zhang, Lian-Ming Wu, Brian F. Baigorri, Yan Yin, Xiao-chuan Geng, Jian-Rong Xu, Jiong Zhu https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4747602/pdf/pone.0147756.pdf
- (en)"Gastric Cancer Staging with Dual Energy Spectral CT Imaging", Zilai Pan, Lifang Pang, Bei Ding, Chao Yan, Huan Zhang, Lianjun Du, Baisong Wang, Qi Song, Kemin Chen, Fuhua Yan, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3570537/pdf/pone.0053651.pdf
- (en) Xuewen Liu, MD, PhD Dian Ouyang, MD Hui Li, MD Rong Zhang, MD, PhD Yanchun Lv, MD, PhD Ankui Yang, MD Chuanmiao Xie, MD, « Papillary Thyroid Cancer: Dual-Energy Spectral CT Quantitative Parameters for Preoperative Diagnosis of Metastasis to the Cervical Lymph Nodes », article, (lire en ligne)
Voir aussi
Bibliographie
- (en) Michael Clark, "Spectral CT: Image processing and revised Hounsfield units", University of Canterbury, 2009
- (en) Michael Anthony Hurrell, Anthony Philip Howard Butler, Nicholas James Cook, Philip Howard Butler, J. Paul Ronaldson, Rafidah Zainon, "Spectral Hounsfield units: a new radiological concept", New Zealand, 2011
- (en) "Techniques to Acquire Spectral CT Data", SPIE, https://spie.org/samples/PM226.pdf
- (en) Polad M Shikhaliev, Shannon G Fritz, "Photon counting spectral CT versus conventional CT:comparative evaluation for breast imaging application", Imaging Physics Laboratory, Department of Physics and Astronomy, Louisiana State University, March 2011
- (en) DSCT.com, Dual Source CT community, http://www.dsct.com
- (en) Leesha Lentz, "A Different Energy — CT Manufacturers Develop Different Approaches to Spectral Scanning", Radiology Today Magazine, March 2014
- Carine Kronland-Martinet, Développement de la tomographie intra-vitale au K-edge avec la caméra à pixels hybrides XPAD3, Centre de Physique des Particules de Marseille, Aix Marseille Université, (lire en ligne)

- (en) A Vlassenbrock, "Dual layer CT", Philips Healthcare, 2011