Strongyloides stercoralis
Anguillule
| Règne | Animalia |
|---|---|
| Embranchement | Nematoda |
| Classe | Secernentea |
| Sous-classe | Rhabditia |
| Ordre | Rhabditida |
| Famille | Strongyloididae |
| Genre | Strongyloides |
Strongyloides stercoralis, communément appelé Anguillule, est une espèce de nématodes de la famille des Strongyloididae, responsable d'une parasitose nommée anguillulose, ou strongyloïdose, ou strongyloïdiase, chez l'homme et chez d'autres espèces animales.
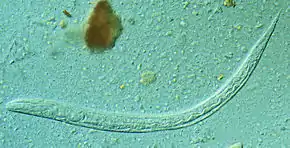
L'anguillule est un ver rond minuscule dont les femelles parthénogénétiques, parasites, sont profondément fixées dans la muqueuse duodénale.
Morphologie
L'anguillule parasite de l'intestin est une minuscule femelle parthénogénétique strongyloïde, très mince et longue de 2 à 3 mm. D'autres formes adultes, mâles et femelles stercoraux n’existent qu’à l'état libre ; elles sont rhabditoïdes et atteignent 1 mm, pour la femelle, et 0,7 mm, pour le mâle.
Biologie
La femelle parthénogénétique vit profondément insérée dans la muqueuse duodéno-jéjunale. Non hématophage, elle pond, dans la muqueuse, des œufs ressemblant à ceux de l'ankylostome, mais longs de 50 µm seulement, morulés dès la ponte, et qui évoluent très vite sur place. Les larves (rhabditoïdes) qui en sortent peuvent évoluer selon trois cycles différents :
- un cycle indirect sexué (cycle long) : la larve, émise avec les selles, donne, dans le milieu extérieur, des adultes mâles et femelles dont la ponte aboutira à une nouvelle génération de larves rhabditoïdes, puis strongyloïdes et enfin strongyloïdes enkystées infectieuses libres ; chacune de ces dernières, agissant comme celle de l'ankylostome, infestera le sujet neuf par voie trans-cutanée et, après une migration organique semblable (circulation, cœur droit, poumon, trachée, œsophage), arrivera au duodénum où elle se transformera en femelle parthénogénétique parasite. Ce cycle, par sa phase sexuée stercorale, aboutit à une multiplication parasitaire non négligeable ;
- un cycle direct parthénogénétique (cycle court) : trouvant des conditions moins favorables, la larve, émise comme la précédente, évolue directement, dans le milieu extérieur, pour donner la larve strongyloïde enkystée infectieuse libre. Infestation et évolution ultérieure se font comme dans le cycle indirect ;
- un cycle hyper-infectieux endogène (cycle d'auto-infestation) : la larve issue de l'œuf parthénogénétique ne quitte pas la lumière intestinale ; elle évolue sur place jusqu'au stade de larve strongyloïde enkystée infectieuse qui, par voie transmuqueuse cette fois, suivra la même migration organique pour aboutir, dans le duodénum, à la femelle parthénogénétique.
Répartition géographique et importance
Cette espèce provoque une affection très répandue dans les aires où règne l'ankylostomose, mais qui par sa plus grande tolérance en matière de température, est en train de gagner du terrain en climat tempéré au départ des porteurs venant des zones d'endémie traditionnelle. Souvent bénigne, elle n'en pose pas moins, parfois, un problème médical difficile, et par sa résistance aux thérapeutiques courantes, et par l'existence, chez les sujets débilités, du cycle hyper-infectieux : ce dernier, en effet, sans stade de vie libre et sans ré-infestations extérieures, entraîne une augmentation croissante du taux des parasites par auto-infestation interne, avec généralisation et issue fatale.
Réactivation d'une strongyloïdose en cas d'immunosuppression
Chez un patient en bonne santé l'infestation peut être asymptomatique ou pauci-symptomatique avec des vers survivant dans l'organisme en phase latente durant des années ou décennies.
En cas d'immunosuppression associée à une maladie dégradant l'immunité (ex SIDA/HIV[1],[2]) ou à un traitement de type corticothérapie[3], chimiothérapie ou médicament immunosuppresseur, un « syndrome d’hyperinfestation » apparaît et peut mettre la vie du patient en danger. Une sérologie par test Elisa est recommandée pour les patients à risques (ayant séjourné dans une zone d'infestation), mais elle peut être faussement négative (88 à 95 % des cas sont supposés détectés, mais 5 à 12 % ne le sont pas, et des réactions croisées sont possibles avec d'autres helminthiases telles que filariose, ascaridiase ou schistosomiase[4] ; le dépistage sérologique peut donc être complété par un à trois examens coprologiques[5].
Mise en évidence
Strongyloides stercoralis peut être retrouvé à l'aide de plusieurs examens complémentaires, dont le plus commun est l'examen parasitologique des selles.
Notes et références
Références taxonomiques
- (fr) Référence Catalogue of Life : Strongyloides stercoralis (Bavay, 1876)
- (en) Référence Fauna Europaea : Strongyloides stercoralis
- (en) Référence Animal Diversity Web : Strongyloides stercoralis
- (en) Référence NCBI : Strongyloides stercoralis (taxons inclus)
Notes et autres références
- Meamar AR, Rezaian M, Mohraz M, Hadighi R, Kia EB. (2007), Strongyloides stercoralis hyper-infection syndrome in HIV+/AIDS patients in Iran. Parasitol Res 2007;101: 663-5.
- Marchi BJ, Cantos GA (2003). Evaluation of techniques for the diagnosis of Strongyloides stercoralis in human immunodeficiency virus (HIV) positive and HIV negative individuals in the city of Itajai, Brazil. Braz J Infect Dis ;7:402-8
- Fardet L, Genereau T, Cabane J, Kettaneh A. Severe strongyloidiasis in corticosteroid-treated patients. Clin Microbiol Infect 2006;12:945-7.
- Siddiqui AA, Berk SL. (2001) Diagnosis of Strongyloides stercoralis infection. Clin Infect Dis ;33:1040-7.
- L. Gétaz N. Mezger V. Piguet P.-Y. Dietrich L. Favet (2009) Lymphome et prurit : une association parfois parasitée ; Revue Médicale Suisse n° 204 (20/05/2009)
Voir aussi
Articles connexes
Lien externe
Bibliographie
- Adella R. Estrongiloidiasis : Epidemiología, manifestaciones clínicas y diagnóstico. Experiencia en una zona endémica : la comarca de La Safor (Valencia). Enferm Infecc Microbiol Clin 2007;25(Suppl. 3):38-44.
- Portail de la médecine
- Portail de la zoologie
- Portail de la parasitologie