Sulfate d'argent
Le sulfate d'argent est un composé ionique de l'argent utilisé dans le placage à l'argent et comme un substitut du nitrate d'argent non tachant. Ce sulfate est stable dans les conditions ordinaires d'utilisation et de stockage, cependant il noircit à la lumière.
| Sulfate d'argent | |
2 · Ag+ + 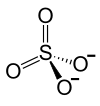 |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.030.581 |
| No CE | 233-653-7 |
| Apparence | Cristaux blancs à gris clair |
| Propriétés chimiques | |
| Formule | Ag2SO4 |
| Masse molaire[1] | 311,799 ± 0,007 g/mol Ag 69,19 %, O 20,53 %, S 10,28 %, |
| Propriétés physiques | |
| T° fusion | 652 °C |
| T° ébullition | décomposition à 1 085 °C |
| Solubilité | 8 g·L-1 eau à 25 °C |
| Masse volumique | 5,45 |
| Précautions | |
| SIMDUT[2] | |
Produit non contrôlé |
|
| Directive 67/548/EEC | |
 Xi |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Préparation
Le sulfate d'argent est préparé en ajoutant de l'acide sulfurique à une solution de nitrate d'argent.
- 2 Ag+(aq) + SO42−(aq) → Ag2SO4 (s)
Le précipité est alors lavé dans de l'eau chaude. La préparation se fait sous lumière rouge.
Propriétés

Solubilité aqueuse du sulfate d'argent
Le sulfate d'argent est peu soluble dans l'eau.
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Sulfate d'argent » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Portail de la chimie
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons - Attribution - Partage dans les Mêmes. Des conditions supplémentaires peuvent s'appliquer aux fichiers multimédias.